|
|
| (26 versions intermédiaires par 4 utilisateurs non affichées) |
| Ligne 1 : |
Ligne 1 : |
| − | <center><b><font size="-2">''Infos tirées de BRIAN GETTING (High Times), PHILIPPE MORARD (Cultures végétales hors-sol), et de "Comment suractiver votre jardin ?"; images tirées du net et de G-IMAGING.''</font></b></center>
| + | =Introduction= |
| − | <br>
| |
| | Le pH a un impact bien défini sur la santé des plantes. Un niveau de pH incorrect peut rendre les nutriments indisponibles à la plante, et même causer leur disparition du sol. On trouvera ici comment contrôler cette variable volatile. | | Le pH a un impact bien défini sur la santé des plantes. Un niveau de pH incorrect peut rendre les nutriments indisponibles à la plante, et même causer leur disparition du sol. On trouvera ici comment contrôler cette variable volatile. |
| − | <br>
| |
| − | <br>
| |
| − | <h2>Intro</h2>
| |
| − | En regardant les informations disponible sur le net et sur les livre traitant de la culture, j'ai réalisé qu'il y'a énormément d'infos sur le "''Comment faire ?''", mais très peu sur le "''Pourquoi faire ainsi ?''".
| |
| − | Un bon exemple en est le pH. Il y a beaucoup d'infos sur "''Comment changer le pH ?''", "''Comment le contrôler ?''", et combien il est important, mais il y'a très peu d'infos sur "''Qu'est-ce que le pH ?''" et "''Pourquoi est-il important ?''". <br>
| |
| − | Pourquoi les cultivateurs doivent-ils se soucier du pH ? Simplement, si le pH (la balance acidité-alkalinité dans le substrat) n'est pas correct, les plantes pousseront pauvrement ou mourront. Un pH impropre provoquera un manque dans "l'habilité phisiologique" des racines à prendre des nutriments, causera un bloquage nutritif, ainsi qu'un déplacement des nutriments dans le sol.<br>
| |
| − | <br>
| |
| − | Quand on parle du pH dans un jardin, on parle autant du pH du sol que du pH de l'eau ou de la solution nutritive. Nous savons tous que les racines rassemblent l'eau et les minéraux dont la plante a besoin pour survivre. Comment ceci se passe est primordiale pour comprendre comment les niveaux de pH affectent la capacité d'une plante à se nourrir.
| |
| − | <br>
| |
| − | <h2>Chimie et Maths</h2 >
| |
| − | L'expression pH est une expression mathématique, mais nous devons un peu plonger aussi dans la chimie, ce que nous ferons à travers quelques phrases simples. L'idée est de donner une signification à des termes tels que pH, ce qui ne sera pas très effrayant. Enfin, vous pouvez toujours lire des chapitres entiers de bouquin consacré au pH, mais si vous ne comprenez pas ce que vous lisez, vos plantes ne connaitront pas un meilleur sort.
| |
| − | <br>
| |
| − | <h4>Définition</h4>
| |
| − | Le potentiel hydrogène '''pH''' est une expréssion chiffrée qui permet d'évaluer le force de l'acidité ou de l'acalinité d'une solution acqueuse, par la connaissance de la concentration en ion hydrogéne <font color="darkblue"><b>H+</b></font> ou ion hydronium <font color="darkblue"><b>H3O+</b></font>.
| |
| − | <br>
| |
| − | <h5>Solution neutre</h5>
| |
| − | L'eau pure à l'état liquide subit une autodissociation; une infime partie se trouve sous forme d'ions <font color="darkblue"><b>H+</b></font> (hidratés en ions hydronium <font color="darkblue"><b>H3O+</b></font>) et d'ions <font color="darkblue"><b>OH-</b></font> (hydroxyles); par conséquent , on trouve dans ce millieu des ions <font color="darkblue"><b>H3O+</b></font>et <font color="darkblue"><b>OH-</b></font> :
| |
| | | | |
| − | * <font color="darkblue"><b>2 H2O</b></font> <==> <font color="darkblue"><b>H3O+</b></font> + <font color="darkblue"><b>OH-</b></font>
| + | =Le pH et les réactions acido-basiques = |
| − | | + | Tous les cultivateurs, et principalement ceux qui choisissent les cultures hors-sol (hydroponie/aéroponie), se retrouvent un jour confrontés à la gestion du pH de leur solution nutritive, avec toutes les questions qui se posent indubitablement : |
| − | La constante de dissociation est de "10 (puissance)*-14", ce qui correspond à une molécule d'eau dissociée pour "10*14" molécules non-dissociées, soit un rapport de 1/"10*14".
| + | * pourquoi ça monte ? |
| − | Cette valeur de "10*-14" est appellée produit ionique: <br>
| + | * pourquoi ça baisse? |
| − | <font color="darkblue"><b>Ke</b></font> = <font color="darkblue"><b>[H3O+] [OH-]</b></font> = 10*-14" mol/l. <br>
| + | * pourquoi quand je mets moins de pH Down, ça baisse encore plus? |
| − | Dans l'eau pure, la concentration des ions hydroniums est égale à celle des hydroxyles: [H3O+]=[OH-]; donc, la concentration de ces ions ne peut prendre qu'un seule valeur: "10*-7", soit: Ke = <font color="darkblue"><b>[H3O+]</b></font>*-7" <font color="darkblue"><b>[OH-]</b></font>*-7" = "10*-14. <br>
| + | * Pourquoi le pH me fait corriger chaque jour et fait le yoyo ?... |
| − | Comme de tels nombres ne sont pas faciles à manipuler, on caractérise chaque concentration par le logarithme décimal changé de signe: PH = -log<font color="darkblue"><b>[H3O+]</b></font>. Ainsi, pour l'eau liquide pure, ou "solution neutre", on obtient: PH = -log(10*-7) donc ph=7.
| |
| | <br> | | <br> |
| − | <h5>Solution acide</h5>
| + | Bienvenue dans le monde merveilleux des réactions acido-basiques. |
| − | Quand on dissout dans l'eau un acide "fort", ce dernier libère des ions <font color="darkblue"><b>H+</b></font>, donc des ions <font color="darkblue"><b>H3O+</b></font>. Par exemple, quand on ajoute de l'acide nitrique à de l'eau pure, il se dissocie en <font color="darkblue"><b>H+</b></font> et en <font color="darkblue"><b>NO3-</b></font> et apporte beaucoup d'ions <font color="darkblue"><b>H+</b></font> (<font color="darkblue"><b>H3O+</b></font>). L'équilibre est déplacer et le liquide acidulé contiendra une proportion d'ion <font color="darkblue"><b>H+</b></font> supèrieur à 10*-7. Par exemple, si après cet apport la solution nutritive contient 1/100 = 10*-3 d'<font color="darkblue"><b>H+</b></font>, le ph est alors de 3. Les millieux acides ont un ph<7; l'acidité s'exprime donc par des ph compris de 0 à 7.
| |
| − | <br>
| |
| − | <h5>Solution basique</h5>
| |
| − | L'introduction d'une base (voir + haut) dans l'eau apporte des ions <font color="darkblue"><b>OH-</b></font>: on observe aussi un déplacement de l'équilibre. Quand on ajoute de la soude (disocié en <font color="darkblue"><b>Na+</b></font> et <font color="darkblue"><b>OH-</b></font>), la proportion des ions <font color="darkblue"><b>OH-</b></font> va augmenter , ce qui fait diminuer celle des ions <font color="darkblue"><b>H+</b></font> (ou <font color="darkblue"><b>H3O+</b></font>). Par exemple, après l'apport de soude, si la proportion est de 1 <font color="darkblue"><b>H+</b></font> pour 10 milliards de molécules d'eau soit 1/10*10 , le pH est alors de 10 . Les millieux basiques ont un pH >7; l'alcalinité (ou la basicité) s'exprime donc par des pH compris entre 7 et 14.
| |
| | <br> | | <br> |
| | | | |
| − | <h4>Vision dynamique de l'eau</h4>
| + | = Théorie générale = |
| − | Un peu de chimie: La molécule d'eau consiste en un atome d'oxigène combiné à 2 atomes d'hydrogéne. L'eau a plusieurs qualités uniques, l'une d'entre elles est sa capacité à "s'auto-ioniser", sa capacité à se séparer en Ion.<br> | + | == Acide, base et pH == |
| − | Dans le cas de l'eau, on obtient des ions hydrogènes chargés positivement, appelés protons (<font color="darkblue"><b>H+</b></font>), et des ions hydroxyl chargés négativement (<font color="darkblue"><b>OH-</b></font>). La charge de ces ions les attire vers les molécules d'eau environnante (qui l'entoure), ou bien s'attire à nouveau l'un l'autre; dans ce cas, ils se recombinnent pour former à nouveau de l'eau. Dans la plupart des cas, l'eau existe dans cet état de transition tout le temps.<br>
| + | Un acide, c'est un composé chimique qui à la capacité de donner au moins un proton hydrogène H{{Exp|+}} en solution aqueuse, on parle "ions acides". |
| − | Cependant, si des protons (<font color="darkblue"><b>H+</b></font>) sont ajoutés à la solution, ils se dissolvent et se heurtent au maximum d'ions hydroxyel (<font color="darkblue"><b>OH-</b></font>) qu'ils peuvent, formant ainsi de nouvelles molécules d'eau. Cependant, comme il n'y aura pas plus d'ions hydroxyl (<font color="darkblue"><b>OH-</b></font>), il y aura donc des protons (<font color="darkblue"><b>H+</b></font>) supplémentaires gravitant autour. <br>
| + | Une base, à l'inverse, est un composé qui peut recevoir au moins un proton H{{Exp|+}} en solution aqueuse. Ce sont les "ions basiques", principalement hydroxydes (OH{{Exp|-}}), mais d'autres réagissent comme des bases, comme les ions bicarbonates (HCO{{Ind|3}}{{Exp|-}}).<br> |
| − | Des protons en + rendent une solution acide: ils se combinent avec l'eau pour former un ion hydronium (<font color="darkblue"><b>H3O+</b></font>). D'un autre côté, si la molécule se dédouble tout le temps, qu'est ce qui fait qu'on obtient des protons en moins ? les ions hydroxyle (<font color="darkblue"><b>OH-</b></font>) n'auraient rien à réagir avec, et il y aurait une augmentation en ions hydroxyle dans la solution. On obtient alors une solution alcaline, que nous appelons "base".<br>
| + | Il faut également parler des sels, ils sont simplement les produits d'un acide sur une base (acide+base = eau+sel). Généralement neutres, il existe cependant des sels acides comme le citrate de sodium, ou des sels basiques comme le bicarbonate de sodium.<br> |
| − | Naturellement, c'est un cours accéléré très simplifié sur le pH, et il y a des livres entiers sur ce sujet. Cependant, pour ce que nous avons besoin ici, ça nous suffit, parce que le point principal que j'essaye de transmettre est que le pH est la mesure des protons dans une solution. <br>
| + | L'acidité, qui se mesure en unités pH, reflète le rapport entre ions acides H{{Exp|+}} et les ions basiques hydroxydes OH{{Exp|-}}.<br> |
| − | <br> | + | L'échelle pH va de 0 à 14, O étant l'extrême acide, 14 l'extrême base.<br> |
| − | Un peu de maths maintenant: La mesure du pH avec laquelle nous sommes tous familiers, s'étendant de 0 à 14, décrit la quantité de protons dans une solution. Plus de protons sont dans une solution, le plus acide elle est, et plus la valeur du pH est basse. Plus la valeur du pH est haute, au plus il y a de protons dans la solution, et donc plus d'ions d'hydroxyle, le rapprochant davantage d'une base. L'eau pure a un pH de 7, neutre, voulant dire qu'il y a 2 atomes d'hydrogène pour chaque atome d'oxigène, soit <font color="darkblue"><b>H2O</b></font>. Regardez la figure 1 pour avoir une idée. Dessus, vous pouvez voir que l'acide (pH4) a plus de protons (en rouge) que la base (pH10). Pour exemples, l' acide d'estomac a un pH de 2, le vinaigre 3-4, le bicarbonate de soude 8-9, et l'amoniac 10.
| + | Un pH de 7 représente un juste milieu et est dit "neutre" car il compte autant de ions H{{Exp|+}} que de ions OH{{Exp|-}}.<br> |
| | + | A pH 0, le composé chimique acide contient une concentration molaire de 10e.0[H{{Exp|+}}] et 10e.-14[OH{{Exp|-}}].<br> |
| | + | A pH 14, le composé chimique basique contient une concentration molaire de 10e.-14[H{{Exp|+}}] et 10e.0[OH{{Exp|-}}]<br> |
| | + | Et entre les deux, le pH va représenter la différence entre les concentration de H{{Exp|+}} et OH{{Exp|-}}, par exemple :<br> |
| | + | pH 7 = 10e.-7[H{{Exp|+}}] 10e.-7[OH{{Exp|-}}]<br> |
| | + | pH 4 = 10e.-4[H{{Exp|+}}] 10e.-10[OH{{Exp|-}}]<br> |
| | + | Le total des 2 exposants est toujours égal à 14, et le pH correspond toujours à la concentration d'ions H{{Exp|+}} : pH signifie "potentiel hydrogène". Un simple regard sur la définition suffira à comprendre que la valeur pH est exponentielle : pH 6 est 10 fois plus acide que pH 7, ph 5 est 100 fois plus acide que pH 7, pH 4 est 1000 fois plus acide que ph 7, etc.<br> |
| | + | L'eau du robinet, en France, a un PH compris entre 7 et 8. Il nous faudra donc chercher a le faire baisser. Pour cela la manière la plus courante est d'utiliser du ph down, produit contenant des acides et permettant de faire baisser le ph d'une solution en en utilisant de très faibles doses. Pour faire remonter le ph d'une solution il faudra utiliser du ph up! Ces produits sont facilement trouvable dans les Growshops.<br> |
| | <br> | | <br> |
| | | | |
| − | <h2>Transport actif et passif</h2>
| + | == Réaction acido-basique == |
| − | Comment font les plantes pour prendre les nutriments qu'elles ont besoin ? L'idée fausse commune est que les aliments circulent simplement dans la plante, portés par l'eau, en passant par les racines sans restriction ni discernement. Réellement, les racines ont une membrane avec des pores dedans; elle agit en tant que filtre. Imaginez si toutes les molécules de n'importe quelle taille étaient libres d'entrer dans les racines: Il n'y aurait rien pour arrêter des agents pathogènes ou des composés toxiques. Les plantes ont évoluées pour créer des mécanismes qui dictent ce qui peut ou ne peut pas passer la membrane racinaire. Ce transport à travers la membrane racinaire peut être passif (n'exigeant aucune énergie de la plante), ou actif (exigeant un déploiement d'énergie de la part de la plante). <br>
| + | On a vu ci-dessus qu'un acide peut donner un H{{Exp|+}}, et une base le recevoir parce qu'elle est OH{{Exp|-}}. L'eau pure, H{{Ind|2}}O, peut donner un H{{Exp|+}}, vu qu'elle en à 2. Mais si elle le fait, elle devient : H{{Ind|2}}O - H = OH. Et si vous avez suivi, vous aurez compris qu'elle va également pouvoir récupérer un H{{Exp|+}}. Elle peut donc réagir en acide ou en base suivant son partenaire.<br> |
| | <br> | | <br> |
| − | Le transport passif est réalisé par la diffusion simple ou la diffusion facilitée. La diffusion simple se fait comme pour l'eau et quelques autres particules ioniques très petites. Dans cette méthode, les particules sont assez petites pour passer par les pores dans la membrane racinaires. La diffusion facilitée est semblable. Dans cette méthode, les protéines dans la membrane racinaire créent des canaux pour que certains corps dissous et ions passent à travers. Essayez d'imaginer un filtre avec de plus ou moins gros trous dedans ici et là, et vous avez une vue simplifiée de ce processus. Ces canaux peuvent être spécifiques à certaines tailles de particules, alors que d'autres sont spécifiques à une molécule particulière. Dans l'une ou l'autre manière, la plante n'a pas besoin de dépenser de l'énergie.<br>
| + | Ce partenaire, on le trouve en quantité variable dans l'eau du robinet, mais surtout dans les engrais et additifs que vous allez utiliser, qui vont apporter tout un panel de molécules différentes. Certaines seront basiques, d'autre acides, certaines réagiront lentement, d'autres rapidement, vont se combiner entre elles pour en former de nouvelles qui vont encore agir différemment sur le pH de votre solution.<br> |
| | + | Lorsque vous corrigez votre solution avec du Ph down, vous incorporez des ions H{{Exp|+}}, qui vont se combiner aux OH{{Exp|-}} disponibles pour les "annuler", et faire baisser le pH de la solution car ils seront majoritaires. <br> |
| | + | Et ces H{{Exp|+}} majoritaires qui ne sont pas utilisés et vont rester "en attente" jusqu'à ce que d'autres OH{{Exp|-}} soient disponibles pour s'y combiner. Ces OH{{Exp|-}} (et aussi des H{{Exp|+}}) vont être produits par les réactions chimiques entre le substrat, la plante, et les composants des engrais et additifs que vous donnez à vos plantes.<br> |
| | + | Le plus imprévisible est la part d'azote de vos engrais, il est utilisé sous trois formes : les nitrates (ou azote nitrique, NO{{Ind|3}}-), l’azote ammoniacal (ou ammonium, NH{{Ind|4}}{{Exp|+}}) et l’urée CO(NH{{Ind|2}}){{Ind|2}}.<br> |
| | <br> | | <br> |
| − | Pour le transport passif, la plante doit garder une concentration plus élevée de corps dissous à l'intérieur des racines que l'extérieur afin de prendre l'eau (voir le schéma 2). Le transport passif peut être facilité par des protéines dans la membrane, mais il n'est pas plus efficace que la diffusion. Comme de plus en plus de corps dissous et d'ions sont transportés dans des cellules, le potentiel de l'eau change, rendant la diffusion simple impossible, car le changement du potentiel de l'eau stoppe l'écoulement de l'eau et peut même le renverser. Ainsi, pour obtenir plus d'aliments que la diffusion simple ne le permet, la plante doit dépenser de l'énergie. Ceci s'appelle le transport actif. Dans ce processus, les cellules racinaires doivent "échanger" des protons contre les nutriments qu'elles veulent. Cette idée extremement simple est illustrée sur la figure 2, où on peut voir que dans le transport actif, des protons sont exportés de la cellule racinaire. <br>
| + | [[Image:PH-art.jpg]]<br> |
| | <br> | | <br> |
| − | Cela signifie qu'il y aura une différence de pH: La raison de cet "échange" est que les cellules créent un "gradient de protons", ou une différence de pH, entre l'intérieur des cellules racinaire et la solution nutritive de l'extèrieur. Ceci dirige les mécanismes par lesquels les cellules racinaires transportent les corps dissous et les ions à travers sa membrane, et s'appelle une force " proton-motive " (en anglais dans le texte). Pour augmenter ce "gradiant de pH", les cellules expulsent des protons à l'extérieur des racines, ce qui exige de l'énergie de la part de la plante. La force "proton-motive" est créée parce qu'il y a plus de protons libres en dehors de la cellule qu' à l'intérieur. Ca veut dire que le pH en dehors de la cellule racinaire est inférieur à son pH interne.<br>
| + | * Pour être assimilée, l’urée est d’abord transformée en azote ammoniacal par une réaction chimique qui provoque une acidification du milieu.<br> |
| | + | * Les nitrates n’auront pas d’incidence sur le milieu tant qu’ils ne seront pas consommés. Leur assimilation, par les plantes ou les bactéries vivant dans le substrat et la solution, ne fera augmenter le pH que légèrement par échange d’ions OH{{Exp|-}} ou HCO{{Ind|3}}{{Exp|-}}.<br> |
| | + | * L’absorption de NH{{Ind|4}}{{Exp|+}} se fait en contrepartie de la libération d’ions H{{Exp|+}}, donc une acidification. Mais intervient aussi une importante réaction chimique appelée nitrification par les bactéries du substrat, qui transforment l’azote ammoniacal en nitrate. La nitrification dégage des ions H{{Exp|+}} qui vont acidifier le substrat et faire descendre le pH.<br> |
| | <br> | | <br> |
| − | les différentes plantes et les micro-organismes dans le sol ont des pH très spécifique dans lesquelles elles prospèrent. Une des raisons de cette spécificité est que le mecanisme de transport actif dépend du pH. Nous avons vu que le pH en dehors de la cellule racinaire doit être moins élevé que le pH à l'intérieur, de sorte que les racines soient capable d'attirer des nutriments. Pensons à ce qui se produirait si le pH du sol (en dehors de la cellule racinaire) etait augmenté (moins de protons libres). La force d'entraînement du flux nutritif, la force "proton-motive", serait affaiblie jusqu'à ce que le pH du sol soit monté au même niveau que le pH à l'intérieur de la racine. il n'y aurait rien pour amener la prise d' aliments, bien que la plante emploie toujours de l'énergie pour exporter des protons. Cette idée est visualisée sur le schéma 3, où le pH en dehors de la racine est haut (avec des protons en moins). C'est une mauvaise situation, car de l'énergie est dépensée, mais il n'y a aucun aliment entrant. C'est comme dépenser plus d'argent que vous ne gagnez. <br>
| + | Ce dégagement qui perturbe l'équilibre désiré est amplifié ou amoindri par différents facteurs, tels que la température, la surface de solution au contact de l'air, de l'agitation de la solution, de la pression, de la nature des composés chimiques, des rejets de la plante,... et il est donc quasi impossible d'avoir une stabilité parfaite. Ce déséquilibre successif du pH est donc naturel et nécessaire, puisqu'il génère les nutriment essentiels dont la plante à besoin, mais sont compensés par l'adjonction de tampons : les tampons possèdent la propriété de résister au changement de la concentration en ions H{{Exp|+}}, et donc empêche le pH de varier outre-mesure.<br> |
| | <br> | | <br> |
| − | Qu'est ce qu'il se passe si le pH du sol environnant vennait à descendre ? En général, il est nocif que le nombre de protons libres devienne trop haut dans une solution. Nous savons tous à quel point les acides sont corrosifs et réactifs, et cette réactivité est due à ces protons libres. Imaginez si on plaçait une plante dans un système hydro avec une solution d'acide chlorhydrique (pH 1, concentration : 4%): ces protons perturberont les protéines et causeront beaucoup d'autres catastrophes biochimiques, endommageant finalement la plante, à tel point qu'elle ne pourra plus être réparée.<br>
| + | |
| | + | = Le pH et la plante = |
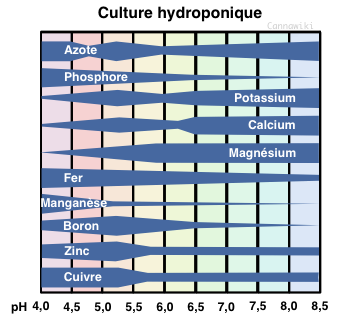
| | + | Les plantes possèdent un pH qui leur est propre. Le pH de la plante doit être le plus proche possible de celui de la solution nutritive et du substrat pour éviter tous risques de conflits électriques entre ses racines et les ions contenus dans la solution nutritive. En fonction de l'acidité de la solution et du substrat, les éléments contenus vont voir leur charge électrique varier, et si cette charge passe "hors-tolérance" de celle admise par les racines de la plante, l'élément de sera pas assimilable.<br> |
| | + | Notre plante chérie, pour pouvoir croître selon ses désirs, à besoin d'un pH compris entre 6 et 7,5 en terre et entre 5.3 et 6.5 en hydroponie, déterminé en fonction de l'engrais. En règle générale, il varie plutôt entre 5.5 et 6. Varie, ça ne veut pas dire qu'il doit bouger au cours de la culture : une fois atteint une valeur dans cette plage, on s'y tient! Et c'est là que commence tout l'art de la maîtrise du pH.<br> |
| | + | |
| | + | [[Image:PH 01.png|CannaWiki]][[Image:PH 02.png|CannaWiki]] |
| | + | |
| | + | == Substrat et pH == |
| | + | La terre ayant un pH d'origine variable en fonction de sa composition, et dans la plupart des cas est adapté à la culture du cannabis. Mais quelle que soit cette composition, il finira toujours par s'acidifier à cause de l'apport régulier d'engrais et donc de la formation de sels. Evitez de démarrer avec une terre trop acide, certains mélanges à base de tourbe ont un pH de 5 qu'il n'est pas rare de voir descendre à 4 au bout de 3 mois, avec tous les désagréments que cela peut apporter à une culture. Pour connaître le pH de la terre il suffit de diluer un échantillon de terre dans de l'eau distillée (eau pure) que nous testerons après quelques heures. Il existe également des appareils qu'il suffit de planter dans la terre quelques instants. Pour changer le pH de la terre nous pourrons utiliser de la chaux pour le faire remonter ou de la terre de bruyère pour le faire baisser.<br> |
| | + | En hydroponie, et je parlerai principalement des systèmes à billes d'argiles, il est primordial d'amener votre substrat à un pH adéquat, comprenez entre 5.5 et 6.0, et de faire en sorte qu'il y reste.<br> |
| | <br> | | <br> |
| − | Le blocage nutritif est une autre source de terreure émanant du pH de votre sol ou de la solution nutritive. L'effet du pH est dramatique sur la solubilité des mineraux et nutriments. Avant qu'un nutriment puisse être puisé par une plante, il doit être dissous dans l'eau de sol. La plupart des nutriments dont les plantes ont besoin sont plus solubles, ou disponible aux plantes, dans les sols acides, plutôt que neutre ou légèrement alkalin. Par exemple, le phosphore est disponible dans un sol près de pH 6.5. Mais si le sol est trop acide, si le pH baisse environ à 4 ou à 5, l'acidité peut causer des concentrations élevées d'aluminium, de fer et de maganese dissous. De telles concentrations peuvent être toxiques à de nombreuses plantes. | + | |
| − | <br> | + | === Le tamponnage === |
| − | <h2>pH et sol</h2>
| + | Les billes d'argiles, sont comme leur nom l'indique, faites d'argile. L'argile utilisée dans ce cas est de l'illite, composé de mica, de formule KAl{{Ind|2}}(AlSi{{Ind|3}}O{{Ind|10}})(OH){{Ind|2}}. A présent, vous avez du reconnaître le OH dans la formule et sa signification : les billes d'argile sont alcalines (basiques), leur pH tourne autour de 8 - 8.5, ce qui est bien trop haut pour espérer amener une culture à terme, il va falloir baisser leur pH entre 5.5 et 6, c'est ce qu'on appelle le tamponnage.<br> |
| − | Jusqu'ici nous avons vu comment le pH affecte la plante et sa capacité à prendre des nutriments, de la rupture des processus biologiques en passant par l'indisponibilité des aliments. Il y a un effet intéressant du pH qui affecte seulement les cultivateurs sur sol (terreau): c'est la réactivité des protons libres avec le sol lui-même. Le sol se compose de beaucoup de particules de différentes tailles, les plus petits d'entre elles s'appellent les micelles.<br>
| + | Pour tamponner des billes, rien de plus simple : il faut les laisser tremper dans de l'eau au pH voulu, jusqu'à ce que l'échange d'ions arrive au point d'équilibre recherché, que les billes contiennent plus d'ions H{{Exp|+}} que OH{{Exp|-}} et soient acides.<br> |
| − | <br>
| + | En regardant à nouveau la formule, on y voit un autre élément, la silice (Si). Lors de la cuisson des billes d'argile, il se peut que cette silice se vitrifie sous l'effet de la température, formant une enveloppe autour de la bille. Cette enveloppe, bien que fragmentée, peut considérablement ralentir le processus de tamponnage : les plus rapides seront tamponnées en 3 jours, d'autres marques peuvent prendre plus de 3 semaines. Il est normal que le pH de l'eau de trempage augmente, les ions H{{Exp|+}} étant captés parles billes, mais ce phénomène corrigé quotidiennement se ralenti puis se stabilise. Si vos billes sont trop vitrifiées, il faudra forcer la réaction en acidifiant plus encore votre eau de trempage : plus bas il sera, plus courte sera la durée. Il n'y a aucun inconvénient à démarrer avec un trempage à pH 2 ou 2.5, mais attention à ce que les billes ne soient pas trop acides au final! Il faudrait alors recommencer l'opération en sens inverse, avec une eau de trempage alcaline, et le risque d'avoir des billes chargées en sels toxiques (rappel : acide+base = eau+sel).<br> |
| − | Les micelles de sol sont chargées négativement. Ceci signifie qu'elles attirent des charges positives. Nous avons parlé des quelques raisons pour lesquelles les protons sont très réactifs. Les chimistes appellent les interactions électrostatiques (ou l'attraction) ce que nous appelons les AFFINITÉS. Ceci prend plus de sens en prenant notre exemple sur le schéma 4. Dans l'exemple, les cations (ions chargés positivement) montrés peuvent être énumérés par affinité, "du plus attiré au moins attré" : <font color="darkblue"><b>H+</b></font>, <font color="darkblue"><b>Na+</b></font>, <font color="darkblue"><b>Ca++</b></font>, <font color="darkblue"><b>Mg++</b></font>. En français, cela signifie qu'un proton a une affinité plus élevée que le calcium, ou que que le magnésium, avec la micelle. Ceci est illustré sur le schéma 4, où vous pouvez voir comment l'addition des protons déloge d'autres ions de la micelle de sol. <br>
| + | Votre tamponnage sera prêt lorsque l'eau de trempage des billes aura un pH entre 5.5 et 6, et que celui-ci n'aura pas bougé pendant une journée au moins.<br> |
| − | <br>
| |
| − | C'est important pour les plantes dans la mesure où il doit y avoir assez de protons libres pour déloger assez de nutriments pour que les plantes les emploient, mais pas trop pour que tout ne soit pas délogé et balayés avec l'eau. Encore, ça explique pourquoi chaque plante a une gamme spécifique de pH. Pour donner une idée de la façon dont tout ceci entre en corrélation, pensez de nouveau à la façon dont les racines exportent des protons afin de pouvoir obtenir des nutriments. Un équilibre fin doit être gardé afin d'assurer le déplacement approprié des aliments du sol, ainsi que pour conduire la prise des ions. <br>
| |
| − | <br>
| |
| − | Gardez à l'esprit que ceci a été extrêmement simplifié, et qu'il y a plus de variables dans la vraie vie. Par exemple, le pH a un effet sur les micro-organismes dans le sol, qui sont essentiels à la survie d'une plante. Ne vous inquiétez pas, il peut toujours être surveillé et controlé. Heureusement, le pH est tout à fait facile à mesurer et à changer, rendant le grand méchant pH moins effrayant.
| |
| | <br> | | <br> |
| | + | === Le rinçage === |
| | + | |
| | + | Les sels, vous l'aurez compris, sont inévitables, et s'accumulent tout au long de la culture dans votre substrat, quel qu'il soit. Une trop grande accumulation de sels est toxique pour la plante, c'est pourquoi il est nécessaire de rincer les substrats réutilisables entre deux cultures.<br> |
| | + | Il s'agit à nouveau d'effectuer un trempage dans une eau à pH corrigé, qui heureusement sera moins long que le tamponnage. Pour faciliter et accélérer la solubilisation des sels, il suffit de baisser légèrement le pH de votre eau, pH 5 est parfait, et d'utiliser une eau chaude. On peut également y ajouter des enzymes pour dégrader les éléments restant, ou dans le cas d'une attaque par une maladie ou champignon faire un rinçage à l'eau de Javel. L'eau de Javel est une base, mais la courte durée de trempage (10-15mn suffisent) fait qu'elle affecte peu le pH des billes. Un second rinçage à l'eau claire et pH adapté est fortement conseillé après un rinçage à la Javel, pour éviter la formation d'éventuels précipités en réaction avec les engrais.<br> |
| | + | |
| | + | == Solution nutritive et pH == |
| | + | Une fois le pH de votre substrat adapté à celui de la plante, il faut que celui de la solution nutritive le soit aussi. Les engrais ont la propriété de faire baisser le pH de votre solution, et ils contiennent, en proportions variables suivant l'application à laquelle ils sont destinés et leur qualité, des tampons qui aident à stabiliser le pH.<br> |
| | + | Une fois l'engrais ajouté à votre eau, le pH de celle ci aura baissé, mais suivant le pH originel de votre eau, il se peut qu'il faille le corriger, généralement le faire baisser. Chose simple, il suffit d'ajouter quelques gouttes de pH down à votre solution. Je déconseille fortement l'usage d'acide acétique (vinaigre), citrique (jus de citron), ou chlorhydrique : les 2 premiers ne produise l'effet recherché que temporairement et vont s'associer aux engrais en formant un précipité ou une molécule complexe et non assimilable, quant à l'acide chlorhydrique il va s'attaquer en priorité aux atomes Ca{{Ind|2}} (calcium) et ainsi supprimer les tampons tant recherchés.<br> |
| | + | Le pH de votre solution devra bien évidement être identique à celui de votre substrat! Si votre tamponnage est correctement réalisé, et que votre solution nutritive est au même pH, il y aura très peu de variation, seuls les rejets de la plantes et la nitrification vont tenter de corrompre cet équilibre mais seront contenus par les tampons des engrais. La majorité des problèmes de pH "yoyo" tient du fait d'un mauvais tamponnage, par exemple de billes avec un pH de 7 et une solution à pH 5.5. Dans ce cas, le mieux est de refaire tremper ses billes et faire un tamponnage digne de ce nom. Si le pH monte mais se stabilise en dessous de 6.5, gardez cette valeur et continuez votre culture avec celle-ci.<br> |
| | + | Un autre phénomène physico-chimique dont je ne rentrerais pas dans les détails peut également être votre allié si votre pH baisse alors que vos billes sont bien tamponnées : l'oxydoréduction. En ajoutant de l'oxygène dans la solution par le biais d'un bulleur, certains éléments de la solution vont perdre un électron, et vont pouvoir capter les H{{Exp|+}} qui passent à proximité : le pH va sensiblement s'élever.<br> |
| | + | On peut également avoir recours à des tampons extérieurs, en ajoutant des éléments à base de silice tels que le Mineral Magic, mais ils ne constituent qu'un palliatif. La qualité de votre eau, de vos engrais, et du tamponnage de votre substrat sont les seules clés de la sérénité dans le monde impitoyable des réactions acido-basiques....<br> |
| | + | |
| | + | == Comment tester le pH d'une solution == |
| | + | |
| | + | Il existe différents systèmes permettant de connaître le PH de l'eau :<br> |
| | | | |
| − | <h2>Mesure et controle</h2>
| + | === Le papier ph === |
| − | Toutes ces informations sur le pH ne veulent pas dire grand chose si on ne peut pas le contrôler, le mesurer, et le mettre au bon niveau. Que ce soit en sol ou en hydroponie, chacun a son propre niveau optimum de pH, aussi bien que ses propres problèmes de pH qui leur sont associés. Le sol est un peu moins "regardant" que la culture hydroponique avec le respect du pH, en raison de ses capacités "tampons". Ceci signifie que dans un sol, le pH ne bougera pas trop quand vous le testez et l'ajustez; ainsi les problèmes de pH sont plus lents à surgir. Le pH optimum pour le sol est entre 6.2-6.5. Ceci signifie que le sol devrait être légèrement acide. Ce n'est pas une gamme absolue, et les plantes ne montreront probablement aucun signe des problèmes de pH si il descend à 6.0 ou atteint 6.8. <br>
| |
| − | <br>
| |
| − | Le pH en hydro est plus instable, vu qu'il n'y a pas de sol pour faire acte de "Buffer" (tampon). Beaucoup des engrais chimiques qui sont disponible sont tamponnés pour vous, et fonctionnent à merveilles avec de l'eau dure (carbonatée). Quelques engrais (additifs) hydroponiques organiques sont des "buffers", mais beaucoup n'en sont pas. Même si le produit que vous employez est tamponé, vérifie le pH reguliairement. Le pH des solutions hydroponiques peut être instable, en tout cas beaucoup plus facilement que dans le sol. La gamme idéale de pH dans la culture hydroponique est entre 5.8-6.2, légèrement inférieur au sol. La culture hydroponique pardonne moins que le sol, il n'est pas recommandé de dévier de cette fourchette. Le blocage de nutriment peut être un problème en hydro, et rappellez-vous que les plantes expulsent des protons des racines pendant qu'elles recueillent des aliments, ainsi le pH baissera lentement au fur et à mesure du temps. <br>
| |
| − | <br>
| |
| − | Le contrôle du pH est très différent dans la culture en sol et dans la culture hydroponique. Avant, j'ai mentionné que le sol pardonnait beaucoup les "écarts" de pH, en raison de sa capacité tampon. C'est une bonne chose, parce que le pH ne devrait pas oscillier, d'un côté ou de l'autre, trop rapidement. Cependant, ça devient un problème quand le pH du sol est mauvais et qu'il a besoin d'être ajusté. Quand le pH est vraiment loin (1 unité de pH) de ce qu'il devrait être, il est probablement mieux de transplanter la plante dans un nouveau sol. <br>
| |
| − | <br>
| |
| − | Cependant, vous pouvez changer le pH progressivement (<1 unité de pH) en ajoutant des acides faibles ou des bases faibles. Il apparait que l'acide phosphorique (<font color="darkblue"><b>H3PO4</b></font>) est un acide faible, peu agréssif, qui peut être employé pour abaisser le pH. A mesure que vous ajouterez les protons pour abaisser le pH, vous fournirez également des ions phosphate, qui sont un aliment crucial pour les plantes. Le vinaigre fonctionnera également assez bien. <br>
| |
| − | <br>
| |
| − | Pour remonter le pH, employez une base faible, telle que l'ammoniaque. L'ammoniaque <font color="darkblue"><b>NH3</b></font> forme un ion ammonium <font color="darkblue"><b>NH4+</b></font>) une fois mis dans la solution, de tel sorte qu'il "s'aproprie" des protons de l'eau, fesant ainsi monter le pH. L'ion ammonium est un autre aliment qui sera ensuite puisé par la plante; ainsi la boucle est bouclée. Des méthodes plus accessibles comme le jus de citron ou le vinaigre permettent d'abaisser le pH, et la chaux de dolomite ou le bicarbonate de soude le remonte. Comme le support de la soude contient beaucoup de sodium, je ne le recommande pas. Par contre, La chaux de dolomite contient du calcium et du magnésium, qui alimentent la plante. <br>
| |
| − | <br>
| |
| − | La 1ère étape pour éviter les soucis de pH est de se faire une bonne terre. Un bon mélange standard de terreau peut être réalisé à base d'amendments organiques et compléter avec l'addition de mousse de tourbe. Il faut penser que la mousse de tourbe baisse légèrement le pH du mélange, ainsi on ajoutera un peu de chaux de dolomite pour équilibrer cela. Les amendements organiques tels que la poussière de coquille feront monter le pH légèrement, il faudra là encore compenser.<br>
| |
| − | D'une manière primordiale, examinez le pH du sol AVANT QUE vous mettiez une plante dedans. Avec un sol équilibré d'entré, on ne devrait pas avoir de problème de pH, aussi longtemps que l'eau qui alimente vos plantes est au bon pH. Veillez à examiner l'eau qui alimente vos plantes. Si le pH est mauvais, ajustez-l'avant l'alimentation. Si vous ne le faites pas, au fur et à mesure, le pH du sol changera car l'effet tampon s'amoindrira, des minéraux se déplaceront, et de multiples signes de carences apparaitront.<br>
| |
| − | Notez que des engrais et/ou additifs que vous utilisez abaisse votre pH sans utilisé de pH- par exemple. Il est donc possible d'obtenir une solution d'arrosage avec un pH légèrement acide à partir de l'eau du robinet assez facilement en rajoutant à l'eau des enzymes, des acides humiques ou fulviques, des champignons bénéfiques ou d'autres additifs (top max, bud fuel, green sensation, .....).
| |
| − | Attention, certains additifs font monter le pH: rhizotonic, les additifs à base de silice, .... <br>
| |
| − | <br>
| |
| − | Permettez moi ici de traiter d'un aspect qui pourrait vous inciter à rempoter plus souvent, sachant que, alors et en plus, vous n'aurez quasiment plus à fertiliser ni a vous ocuper du ph de votre eau du robinet (CEC oblige, voir prochain chapitre). <br>
| |
| − | Voilà, il sagit des REACTIONS DE BIO-DEGRADABILITE: "Les substrats d'origine organique peuvent évoluer dans le temps par l'activité de micro-organismes: la minéralisation des substances organiques se traduit par une perte de la matière sèche et provoque une diminution du volume de substrat. Ces transformations biologiques produisent d'autres effets indésirables: elles s'accompagnent généralement d'un affaissement des structures et de la diminution de la porosité à l'air; la compétition entre la microflore et les racines peut aussi provoquer une faim en azote pour la culture et affecter la respiration racinaire.(...) Pour estimer leur potentiel de bio-dégradabilité, on utilise le rapport entre leurs compositions en carbone et en azote (C/N): plus ces valeurs sont faibles, plus ils (C et N) seront facilement utilisé par la microflore.(...) Le rapport C/N peut donc fournir une information sur la stabilité du produit dans le temps: les composés lignocellulosiques à base de végétaux avec un C/N infèrieur à 80 se dégradent assez facilement; par contre, des écorces de pin maritime non compostées, avec un C/N de 300, se décomposent très lentement. " (C.V.H.S.,P.Morard)<br>
| |
| − | <br>
| |
| − | Si vous remarquez que vos plantes souffre, et que vous remarquez que le pH du sol est en dehors de la fourchette 6.0-6.8, la 1ère des bonnes mesures est de léssiver le sol avec beaucoup d'eau pure. Ceci enlèvera les produits chimiques et les sels en trop, ce qui aidera dans la remise à niveau et le maintient du pH. Après léssivage, faites une solution au pH que vous voulez, et arrosez le sol avec cette solution. Faites attention à ne pas ajouter trop de pH- ou +, et laissez le sol se reposer pendant quelques minutes avant de tester le pH. Une Fois le pH à niveau, n'oubliez pas que votre terre à été léssivé et qu'il faudra donc engraisser.
| |
| − | <br>
| |
| | | | |
| − | <h2>pH, substrat et C.E.C.</h2>
| + | Vous l'avez sûrement utilisé quand vous étiez en cours de biologie, c'est une petite languette de papier qu'il faut tremper dans la solution a tester. Cette languette de papier prend une certaine couleur en fonction du ph de l'eau, il suffira de comparer cette couleur avec la graduation fournie, chaque couleur équivaut a un degré de pH. Ce système est le moins cher mais également le moins précis.<br> |
| − | Après avoir lu tout ça, vous devez vous demandez pourquoi les niveaux de pH à respecter en terre et en hydro ne sont pas indentique ?
| + | [[Image:pH2.jpg]] [[Image:PH5.jpg|220px]] |
| − | Rapidement, ici intervient la notion de CEC: le terreau relache (entre autre) des ions <font color="darkblue"><b>H+</b></font> , fournissant alors suffisament de protons; si on arroserait au même pH qu'en hydroponie, il y aurait trop de protons puisque le terreau en relàche.<br>
| |
| − | <br>
| |
| − | La Capacité d'Echange cationique est la capacité d'un millieu de croissance à retenir les élément nutritifs afin que les racines puissent les utiliser. La CEC de chaque millieux différents affecte le pH (et la composition de la solution nutritive en hydro, et plus particulièrement les mélanges de types GARDEX qui sont parfois utilisé en hydro sans savoir ce que ça implique). <br>
| |
| − | <br>
| |
| − | La réaction qui se manifeste au niveau du pH est une modification induite par le substrat lors de la l'écoulement de la solution nutritive. Un support peut, en effet, relacher des ions <font color="darkblue"><b>H+</b></font> (le pH baisse) ou des ions <font color="darkblue"><b>OH-</b></font> (qui l'augmente). Il faut savoir en tenir compte pour ne pas avoir de problèmes, et éventuellement "tamponner" le substrat au bon pH avant de commencer la culture. <br>
| |
| − | <br>
| |
| − | Les sols réguliers, avec leurs particules de charges électriques tiennent facilement les éléments nutritifs à la disposition des racines. Celles-ci ont des CEC entre 100 et 200 unités équivalentes. Les mélanges de vermiculite et de tourbe ont des valeurs moyennes CEC de 50 à 60 unités équivalentes. La laine de roche, la perlite et certaines billes d'argiles (Choisissez pour tous vos substrat la norme RHP; renseignez-vous, c'est le choix de la qualité) ont une CEC de zéro. Cela signifie que ces millieux de croissance ne tiennent pas les éléments nutritifs à la disposition des racines de la plante, et une fois un élément passé, il a disparu. Cela veut aussi dire que ces millieux n'ont aucun effet tampon. <br>
| |
| − | <br>
| |
| − | Regardez le tableau ci-dessous sur "l'expèrience sur la disponibilité des éléments nutritifs". Remarquez la différence entre l'absorbtion d'éléments nutritifs avec des mélanges artificiels (millieux de croissance avec CEC bas) et l'absorption équivalente dans les sols réguliers (où il y a un CEC élevé). Gardez un pH entre 6.2 et 6.5 pour les sols avec une CEC haute et entre 5.5 et 6 pour ceux qui ont un CEC de zéro.<br>
| |
| − | <br>
| |
| − | <center>
| |
| − | [[Image:Exprience_nutritifs.jpg]]<br> | |
| − | <br><br>
| |
| − | Le tableau ci-dessous reprend quelques exemples de CEC et de pH qu'on peut trouver associer aux substrats.<br>
| |
| − | <br>
| |
| − | <b>pH et capacité d'échange cationique (CEC) de divers substrats</b><br>
| |
| − | [[Image:Tableau_CEC.jpg]]<br> | |
| − | ''LEMAIRE et al., Cultures en pots et conteneurs, © INRIA, Paris, 1989.''</center>
| |
| − | <br>
| |
| | | | |
| − | J'espère que nous en savons maintenant un peu plus sur le pH et que ça nous aidera à prendre les bonnes décisions pour nos plantes. Si vous êtes face à une plante affamée mais que votre engraissage est suffisant et équilibré, vous devez être face à un problème de pH. Garder un oeil sur le pH peut prévenir un choc qui, autrement, stopperait la croissance des plantes; De plus, un niveau approprié de pH assure à vos plantes une alimentation complète et abondante.
| |
| | <br> | | <br> |
| | | | |
| − | <h2>Conclusions, le pH en pratique</h2>
| + | === Les réactifs === |
| − | Pour beaucoup d'entre nous, les maths et la chimie sont des langues mortes. Alors ici, nous recapituleront quelques applications pratiques et d'autres vérités simple. <br>
| |
| − | <br>
| |
| − | Quand le pH bouge d'1 unité, par exemple de 7 il passe à 6, ça représente une augmentation de 10 fois de l'acidité. Ca vaut qu'un sol à pH 6 est 10 fois plus acide qu'un sol à pH 7. Si le pH descend à 5, le sol sera 100 fois plus acide que s'il était neutre (pH7). bien sûr, un pH de 4 sera 1000 fois plus acide qu'un pH de 7. De la même façon, un pH à 7 sera 1000 fois plus acide qu'un pH à 10. <br>
| |
| − | <br>
| |
| − | On peut mesurer le pH avec des testeurs liquides, mais il est difficile d'interpréter les résultats et facile de faire une mauvaise lecture du résultat. Il y a sinon les testeur électroniques; le résultat s'obtient par lecture digitale. Il faut garder cet instrument propre et le calibrer régulièrement. <br>
| |
| − | <br>
| |
| − | La plupart des engrais acidifient un millieux de croissance avec le temps, et le pH des solutions hydroponiques change souvent pendant que l'eau et des nutriments sont employés. Le pH en hydroponie doit être ajuster rapidement, et si vous ne le faites pas, des signes de déficience vont apparaitre; ils ne seront pas visible immédiatement mais au bout d'1 semaine ou 2. Le temps que vous le remarquiez, le mal sera déja fait. La plupart des récoltes sont développées pendant au moins trois mois, et une simple erreure diminuera le poids des bourgeons. <br>
| |
| − | <br>
| |
| − | Évitez les problèmes de pH en achetant un terreau de qualité et mélangez une tasse de chaux très fine de dolomite par pied/cube avant la plantation. Les cultivateurs hydroponique utilisent de l'acide phosphorique ou nitrique dilué pour baisser le pH. Etant donner que le pH- (acide phosphorique) ne se disolve pas facilement dans l'eau, il est conseillé de le dissoudre au prealable dans un petit volume d'eau chaude (~30cl) avant de le mettre dans la solution. <br>
| |
| − | Gardez un oeil avertie sur le pH et contrôlez-le en conséquence. Après rectification du pH, vérifiez le, puis encore le jour suivant à la même heure. Le nitrate de calcium peut également être employé, mais c'est moins commun. <br>
| |
| | | | |
| − | En dehors de la fourchette appropriée de pH, les aliments deviennent indisponible aux plantes, provoquant leur accumulation, intoxifiant le support de culture et la solution nutritive. Ces conditions toxiques sont faciles à éviter en maintenant un pH approprié et en rinçant reguliairement le support de culture avec une solution d'éléments nutritifs douce (moyenennement dosée). <br>
| + | Ce sont des produits surtout utilisé en aquariophilie, ou pour le test des piscines. Il suffit d'ajouter quelques gouttes de réactifs (liquide) dans une éprouvette ou nous aurons introduit la solution à tester. Cette solution prendra une teinte que nous devrons comparer avec une graduation de couleur. C'est a peu près le même principe que le papier pH. Il est également relativement peu cher et un tout petit peu plus précis! Ces tests sont facilement trouvable dans les animaleries.<br> |
| − | <br>
| + | [[Image:pH3.jpg]] |
| − | Il y a 4 problemes de nutrition associés (mais pas forcément exclusivement liés) au niveau de pH. Ils vont sont montrez sur la photo associé à ce chapitre. Rappelez-vous, que si les feuilles montrent des signes d'insuffisances, vous pouvez compter sur une récolte plus légère. Résolvez le problème avant qu'il commence en prétant attention au pH tous les jours.<br>
| |
| − | <br>
| |
| − | ''Figure 1'': Des eaux à pH 4, 7 et 10 sont exposées. L'eau acide (pH 4) a beaucoup de protons libre en elle. L'eau à pH 7 a exactement 2 protons pour chaque atome d'oxygène, juste comme il faut. L'eau alkaline (pH 10) a bien moins de protons qu'il y a d' ions d'hydroxyle.
| |
| − | <br>
| |
| | <br> | | <br> |
| | + | === Les pH mètres === |
| | | | |
| − | [[Image:Concentration.jpg|right|450px]]
| + | C'est le système le plus précis et le plus pratique! C'est un appareil à piles qu'il suffira de tremper dans la solution. Instantanément il nous donnera le degré de ph sous forme de chiffres inscrit sur un écran. Ce système est plus coûteux mais vraiment très pratique.<br> |
| − | Le transport passif ne nécéssite aucune énergie venant de la plante, et se manifeste par une diffusion simple (à travers les pores de la membrane) ou par une diffusion facilité. Les protéines aide à cela en créant des canaux qui s'adaptent mieux à certains corps dissous (channel proteins), ou en étant spécifique à un corps dissous et en l'aidant à passer à travers (carrier protein).<br>
| |
| − | <br>
| |
| − | Le transport actif demande de l'énergie de la plante, et implique habituellement l'échange d'un proton. Vous pouvez voir en bas que pendant qu'un corps dissous entre, un proton est "pompé" à l'extérieur de la cellule.
| |
| | | | |
| − | [[Image:Transport_des_195_209.jpg|left|450px]] | + | [[Image:Testeur_pH.png|pH HANNA]] |
| − | <br style="clear:both;" />
| |
| − | ''Figure 3:''<br>
| |
| − | * '''a''') Une des façons "d'expulser" des protons pour obtenir des nutriments, est de crer une différence de charge. Puisqu'il y a un pH inférieur en dehors des cellules racinaire qu'à l'intérieur (plus de protons), ça veut dire que la racine sera (...???...). Cette attraction positive amènera les corps dissous dans les racines.<br>
| |
| − | * '''b''') Quand le pH du sol ou du support autour des racines augmente, la charge devient équivalente à celle de l'intèrieur des racines. Le manque de protons libres s'associe à un manque de charge positive, causant ce qui suit: les corps dissous ne sont plus attiré dans la cellule racinaire, bien que cette dernière continue de dépenser de l'énergie pour échanger des protons contre des corps dissous.
| |
| − | <br style="clear:both;" />
| |
| | <br> | | <br> |
| | <br> | | <br> |
| − | <center>
| |
| − | [[Image:Transport_act_165_627.jpg|right|450px]]
| |
| − | </center>
| |
| − | <br>
| |
| − | <br>
| |
| − | ''Figure 4:''<br>
| |
| − | * '''a''') Le sol a une charge négative globale, ainsi il y a une charge positive liée aux particules de sol,les micelles. Les corps dissous chargés negativement sont repoussé du sol, et restentdans l'eau, allant partout où l'eau va. <br>
| |
| − | * '''b''') Les protons sont capable de déloger les autres ions à cause de leur petite taille et de leur forte charge positive. Les ions délogés sont balayés loin avec l'eau et peuvent être lessivé hors du sol.
| |
| − | <br>
| |
| − | <br>
| |
| − | [[Image:Deplacement_des_nutriments.jpg|left|450px]]
| |
| − | <br style="clear:both;" />
| |
| − | <br>
| |
| | | | |
| − | <h2>Carences liées aux fluctuations du pH</h2>
| + | '''''Auteur(s) et source(s) :''''' |
| − | * '''Phosphore''': Un pH au-dessus de 6.2 (culture hydroponique) et de 6.8 (sol) rend souvent le phophorus indisponible. Les signes du déficiences incluent une croissance arrêtée, des feuilles bleuâtre-vertes - souvent avec des taches - et des couleures rougeâtre-pourpres aux tiges et sous les feuilles. <br>
| + | |
| − | <br>
| + | snowflake @ [http://www.cannaweed.com Cannaweed]<br> |
| − | * '''Magnésium''': Un pH en-dessous de 5.5 (culture hydroponique) et de 6.5 (sol) peut rendre le magnésium indisponible. Les symptômes incluent le jaunissement interveinal des feuilles, des taches rouille-brunes irréguliaires sur des feuilles les plus anciennes, et les bouts (des feuilles) brunissant et se courbant vers le haut. <br>
| + | Riko @ [http://www.cannaweed.com Cannaweed] |
| − | <br>
| |
| − | * '''Fer''': Un pH au-dessus de 6.5 cause souvent un manque de fer, ce qui fait devenir les nouvelles pousses en un vert/jaune pâle commençant au petiole , et s'étendant aux plus grandes feuilles jusqu'à développer une chlorose interveinale. <br>
| |
| − | <br>
| |
| − | * '''Zinc''': Maintenez le pH dans une gamme acceptable, 5.8-6.2 (culture hydroponique) et 6.2-6.5 (sol), pour éviter des problèmes avec le zinc. Une deficience causera une chlorose d'interveinale des jeunes feuilles, les nouvelles feuilles seront touchées, les feuilles vont être tombante avant de se décolorer et mourir (...). La croissance de nouveaux bourgeons s'arrêtera en cas de déficience sévère.<br>
| |
| − | <br>
| |
| − | <br>
| |
| − | <center>
| |
| − | [[Image:Ph_en_pratique.jpg]]<br> | |
| − | <br>
| |
| − | [[Image:Fluctph.jpg|Exemple de fluctuations de PH|]]
| |
| − | </center>
| |
| − | <br>
| |
| − | <br>
| |
| − | <br>
| |
| − | <br>
| |
| − | ''par sativ@overweed sept 2006''
| |
Introduction
Le pH a un impact bien défini sur la santé des plantes. Un niveau de pH incorrect peut rendre les nutriments indisponibles à la plante, et même causer leur disparition du sol. On trouvera ici comment contrôler cette variable volatile.
Le pH et les réactions acido-basiques
Tous les cultivateurs, et principalement ceux qui choisissent les cultures hors-sol (hydroponie/aéroponie), se retrouvent un jour confrontés à la gestion du pH de leur solution nutritive, avec toutes les questions qui se posent indubitablement :
- pourquoi ça monte ?
- pourquoi ça baisse?
- pourquoi quand je mets moins de pH Down, ça baisse encore plus?
- Pourquoi le pH me fait corriger chaque jour et fait le yoyo ?...
Bienvenue dans le monde merveilleux des réactions acido-basiques.
Théorie générale
Acide, base et pH
Un acide, c'est un composé chimique qui à la capacité de donner au moins un proton hydrogène H+ en solution aqueuse, on parle "ions acides".
Une base, à l'inverse, est un composé qui peut recevoir au moins un proton H+ en solution aqueuse. Ce sont les "ions basiques", principalement hydroxydes (OH-), mais d'autres réagissent comme des bases, comme les ions bicarbonates (HCO3-).
Il faut également parler des sels, ils sont simplement les produits d'un acide sur une base (acide+base = eau+sel). Généralement neutres, il existe cependant des sels acides comme le citrate de sodium, ou des sels basiques comme le bicarbonate de sodium.
L'acidité, qui se mesure en unités pH, reflète le rapport entre ions acides H+ et les ions basiques hydroxydes OH-.
L'échelle pH va de 0 à 14, O étant l'extrême acide, 14 l'extrême base.
Un pH de 7 représente un juste milieu et est dit "neutre" car il compte autant de ions H+ que de ions OH-.
A pH 0, le composé chimique acide contient une concentration molaire de 10e.0[H+] et 10e.-14[OH-].
A pH 14, le composé chimique basique contient une concentration molaire de 10e.-14[H+] et 10e.0[OH-]
Et entre les deux, le pH va représenter la différence entre les concentration de H+ et OH-, par exemple :
pH 7 = 10e.-7[H+] 10e.-7[OH-]
pH 4 = 10e.-4[H+] 10e.-10[OH-]
Le total des 2 exposants est toujours égal à 14, et le pH correspond toujours à la concentration d'ions H+ : pH signifie "potentiel hydrogène". Un simple regard sur la définition suffira à comprendre que la valeur pH est exponentielle : pH 6 est 10 fois plus acide que pH 7, ph 5 est 100 fois plus acide que pH 7, pH 4 est 1000 fois plus acide que ph 7, etc.
L'eau du robinet, en France, a un PH compris entre 7 et 8. Il nous faudra donc chercher a le faire baisser. Pour cela la manière la plus courante est d'utiliser du ph down, produit contenant des acides et permettant de faire baisser le ph d'une solution en en utilisant de très faibles doses. Pour faire remonter le ph d'une solution il faudra utiliser du ph up! Ces produits sont facilement trouvable dans les Growshops.
Réaction acido-basique
On a vu ci-dessus qu'un acide peut donner un H+, et une base le recevoir parce qu'elle est OH-. L'eau pure, H2O, peut donner un H+, vu qu'elle en à 2. Mais si elle le fait, elle devient : H2O - H = OH. Et si vous avez suivi, vous aurez compris qu'elle va également pouvoir récupérer un H+. Elle peut donc réagir en acide ou en base suivant son partenaire.
Ce partenaire, on le trouve en quantité variable dans l'eau du robinet, mais surtout dans les engrais et additifs que vous allez utiliser, qui vont apporter tout un panel de molécules différentes. Certaines seront basiques, d'autre acides, certaines réagiront lentement, d'autres rapidement, vont se combiner entre elles pour en former de nouvelles qui vont encore agir différemment sur le pH de votre solution.
Lorsque vous corrigez votre solution avec du Ph down, vous incorporez des ions H+, qui vont se combiner aux OH- disponibles pour les "annuler", et faire baisser le pH de la solution car ils seront majoritaires.
Et ces H+ majoritaires qui ne sont pas utilisés et vont rester "en attente" jusqu'à ce que d'autres OH- soient disponibles pour s'y combiner. Ces OH- (et aussi des H+) vont être produits par les réactions chimiques entre le substrat, la plante, et les composants des engrais et additifs que vous donnez à vos plantes.
Le plus imprévisible est la part d'azote de vos engrais, il est utilisé sous trois formes : les nitrates (ou azote nitrique, NO3-), l’azote ammoniacal (ou ammonium, NH4+) et l’urée CO(NH2)2.

- Pour être assimilée, l’urée est d’abord transformée en azote ammoniacal par une réaction chimique qui provoque une acidification du milieu.
- Les nitrates n’auront pas d’incidence sur le milieu tant qu’ils ne seront pas consommés. Leur assimilation, par les plantes ou les bactéries vivant dans le substrat et la solution, ne fera augmenter le pH que légèrement par échange d’ions OH- ou HCO3-.
- L’absorption de NH4+ se fait en contrepartie de la libération d’ions H+, donc une acidification. Mais intervient aussi une importante réaction chimique appelée nitrification par les bactéries du substrat, qui transforment l’azote ammoniacal en nitrate. La nitrification dégage des ions H+ qui vont acidifier le substrat et faire descendre le pH.
Ce dégagement qui perturbe l'équilibre désiré est amplifié ou amoindri par différents facteurs, tels que la température, la surface de solution au contact de l'air, de l'agitation de la solution, de la pression, de la nature des composés chimiques, des rejets de la plante,... et il est donc quasi impossible d'avoir une stabilité parfaite. Ce déséquilibre successif du pH est donc naturel et nécessaire, puisqu'il génère les nutriment essentiels dont la plante à besoin, mais sont compensés par l'adjonction de tampons : les tampons possèdent la propriété de résister au changement de la concentration en ions H+, et donc empêche le pH de varier outre-mesure.
Le pH et la plante
Les plantes possèdent un pH qui leur est propre. Le pH de la plante doit être le plus proche possible de celui de la solution nutritive et du substrat pour éviter tous risques de conflits électriques entre ses racines et les ions contenus dans la solution nutritive. En fonction de l'acidité de la solution et du substrat, les éléments contenus vont voir leur charge électrique varier, et si cette charge passe "hors-tolérance" de celle admise par les racines de la plante, l'élément de sera pas assimilable.
Notre plante chérie, pour pouvoir croître selon ses désirs, à besoin d'un pH compris entre 6 et 7,5 en terre et entre 5.3 et 6.5 en hydroponie, déterminé en fonction de l'engrais. En règle générale, il varie plutôt entre 5.5 et 6. Varie, ça ne veut pas dire qu'il doit bouger au cours de la culture : une fois atteint une valeur dans cette plage, on s'y tient! Et c'est là que commence tout l'art de la maîtrise du pH.

Substrat et pH
La terre ayant un pH d'origine variable en fonction de sa composition, et dans la plupart des cas est adapté à la culture du cannabis. Mais quelle que soit cette composition, il finira toujours par s'acidifier à cause de l'apport régulier d'engrais et donc de la formation de sels. Evitez de démarrer avec une terre trop acide, certains mélanges à base de tourbe ont un pH de 5 qu'il n'est pas rare de voir descendre à 4 au bout de 3 mois, avec tous les désagréments que cela peut apporter à une culture. Pour connaître le pH de la terre il suffit de diluer un échantillon de terre dans de l'eau distillée (eau pure) que nous testerons après quelques heures. Il existe également des appareils qu'il suffit de planter dans la terre quelques instants. Pour changer le pH de la terre nous pourrons utiliser de la chaux pour le faire remonter ou de la terre de bruyère pour le faire baisser.
En hydroponie, et je parlerai principalement des systèmes à billes d'argiles, il est primordial d'amener votre substrat à un pH adéquat, comprenez entre 5.5 et 6.0, et de faire en sorte qu'il y reste.
Le tamponnage
Les billes d'argiles, sont comme leur nom l'indique, faites d'argile. L'argile utilisée dans ce cas est de l'illite, composé de mica, de formule KAl2(AlSi3O10)(OH)2. A présent, vous avez du reconnaître le OH dans la formule et sa signification : les billes d'argile sont alcalines (basiques), leur pH tourne autour de 8 - 8.5, ce qui est bien trop haut pour espérer amener une culture à terme, il va falloir baisser leur pH entre 5.5 et 6, c'est ce qu'on appelle le tamponnage.
Pour tamponner des billes, rien de plus simple : il faut les laisser tremper dans de l'eau au pH voulu, jusqu'à ce que l'échange d'ions arrive au point d'équilibre recherché, que les billes contiennent plus d'ions H+ que OH- et soient acides.
En regardant à nouveau la formule, on y voit un autre élément, la silice (Si). Lors de la cuisson des billes d'argile, il se peut que cette silice se vitrifie sous l'effet de la température, formant une enveloppe autour de la bille. Cette enveloppe, bien que fragmentée, peut considérablement ralentir le processus de tamponnage : les plus rapides seront tamponnées en 3 jours, d'autres marques peuvent prendre plus de 3 semaines. Il est normal que le pH de l'eau de trempage augmente, les ions H+ étant captés parles billes, mais ce phénomène corrigé quotidiennement se ralenti puis se stabilise. Si vos billes sont trop vitrifiées, il faudra forcer la réaction en acidifiant plus encore votre eau de trempage : plus bas il sera, plus courte sera la durée. Il n'y a aucun inconvénient à démarrer avec un trempage à pH 2 ou 2.5, mais attention à ce que les billes ne soient pas trop acides au final! Il faudrait alors recommencer l'opération en sens inverse, avec une eau de trempage alcaline, et le risque d'avoir des billes chargées en sels toxiques (rappel : acide+base = eau+sel).
Votre tamponnage sera prêt lorsque l'eau de trempage des billes aura un pH entre 5.5 et 6, et que celui-ci n'aura pas bougé pendant une journée au moins.
Le rinçage
Les sels, vous l'aurez compris, sont inévitables, et s'accumulent tout au long de la culture dans votre substrat, quel qu'il soit. Une trop grande accumulation de sels est toxique pour la plante, c'est pourquoi il est nécessaire de rincer les substrats réutilisables entre deux cultures.
Il s'agit à nouveau d'effectuer un trempage dans une eau à pH corrigé, qui heureusement sera moins long que le tamponnage. Pour faciliter et accélérer la solubilisation des sels, il suffit de baisser légèrement le pH de votre eau, pH 5 est parfait, et d'utiliser une eau chaude. On peut également y ajouter des enzymes pour dégrader les éléments restant, ou dans le cas d'une attaque par une maladie ou champignon faire un rinçage à l'eau de Javel. L'eau de Javel est une base, mais la courte durée de trempage (10-15mn suffisent) fait qu'elle affecte peu le pH des billes. Un second rinçage à l'eau claire et pH adapté est fortement conseillé après un rinçage à la Javel, pour éviter la formation d'éventuels précipités en réaction avec les engrais.
Solution nutritive et pH
Une fois le pH de votre substrat adapté à celui de la plante, il faut que celui de la solution nutritive le soit aussi. Les engrais ont la propriété de faire baisser le pH de votre solution, et ils contiennent, en proportions variables suivant l'application à laquelle ils sont destinés et leur qualité, des tampons qui aident à stabiliser le pH.
Une fois l'engrais ajouté à votre eau, le pH de celle ci aura baissé, mais suivant le pH originel de votre eau, il se peut qu'il faille le corriger, généralement le faire baisser. Chose simple, il suffit d'ajouter quelques gouttes de pH down à votre solution. Je déconseille fortement l'usage d'acide acétique (vinaigre), citrique (jus de citron), ou chlorhydrique : les 2 premiers ne produise l'effet recherché que temporairement et vont s'associer aux engrais en formant un précipité ou une molécule complexe et non assimilable, quant à l'acide chlorhydrique il va s'attaquer en priorité aux atomes Ca2 (calcium) et ainsi supprimer les tampons tant recherchés.
Le pH de votre solution devra bien évidement être identique à celui de votre substrat! Si votre tamponnage est correctement réalisé, et que votre solution nutritive est au même pH, il y aura très peu de variation, seuls les rejets de la plantes et la nitrification vont tenter de corrompre cet équilibre mais seront contenus par les tampons des engrais. La majorité des problèmes de pH "yoyo" tient du fait d'un mauvais tamponnage, par exemple de billes avec un pH de 7 et une solution à pH 5.5. Dans ce cas, le mieux est de refaire tremper ses billes et faire un tamponnage digne de ce nom. Si le pH monte mais se stabilise en dessous de 6.5, gardez cette valeur et continuez votre culture avec celle-ci.
Un autre phénomène physico-chimique dont je ne rentrerais pas dans les détails peut également être votre allié si votre pH baisse alors que vos billes sont bien tamponnées : l'oxydoréduction. En ajoutant de l'oxygène dans la solution par le biais d'un bulleur, certains éléments de la solution vont perdre un électron, et vont pouvoir capter les H+ qui passent à proximité : le pH va sensiblement s'élever.
On peut également avoir recours à des tampons extérieurs, en ajoutant des éléments à base de silice tels que le Mineral Magic, mais ils ne constituent qu'un palliatif. La qualité de votre eau, de vos engrais, et du tamponnage de votre substrat sont les seules clés de la sérénité dans le monde impitoyable des réactions acido-basiques....
Il existe différents systèmes permettant de connaître le PH de l'eau :
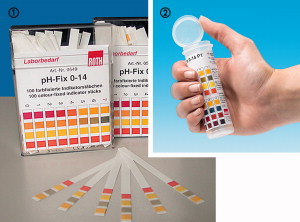
Le papier ph
Vous l'avez sûrement utilisé quand vous étiez en cours de biologie, c'est une petite languette de papier qu'il faut tremper dans la solution a tester. Cette languette de papier prend une certaine couleur en fonction du ph de l'eau, il suffira de comparer cette couleur avec la graduation fournie, chaque couleur équivaut a un degré de pH. Ce système est le moins cher mais également le moins précis.

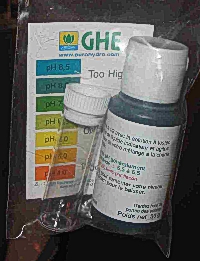
Les réactifs
Ce sont des produits surtout utilisé en aquariophilie, ou pour le test des piscines. Il suffit d'ajouter quelques gouttes de réactifs (liquide) dans une éprouvette ou nous aurons introduit la solution à tester. Cette solution prendra une teinte que nous devrons comparer avec une graduation de couleur. C'est a peu près le même principe que le papier pH. Il est également relativement peu cher et un tout petit peu plus précis! Ces tests sont facilement trouvable dans les animaleries.
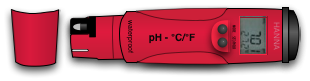
Les pH mètres
C'est le système le plus précis et le plus pratique! C'est un appareil à piles qu'il suffira de tremper dans la solution. Instantanément il nous donnera le degré de ph sous forme de chiffres inscrit sur un écran. Ce système est plus coûteux mais vraiment très pratique.
Auteur(s) et source(s) :
snowflake @ Cannaweed
Riko @ Cannaweed






