« Le pH » : différence entre les versions
(Nouvelle page : <center><b><font size="-2">''Infos tirées de BRIAN GETTING (High Times), PHILIPPE MORARD (Cultures végétales hors-sol), et de "Comment suractiver votre jardin ?"; images tirées d...) |
m (→Le papier ph) |
||
| (26 versions intermédiaires par 4 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
=Introduction= | |||
Le pH a un impact bien défini sur la santé des plantes. Un niveau de pH incorrect peut rendre les nutriments indisponibles à la plante, et même causer leur disparition du sol. On trouvera ici comment contrôler cette variable volatile. | Le pH a un impact bien défini sur la santé des plantes. Un niveau de pH incorrect peut rendre les nutriments indisponibles à la plante, et même causer leur disparition du sol. On trouvera ici comment contrôler cette variable volatile. | ||
=Le pH et les réactions acido-basiques = | |||
Tous les cultivateurs, et principalement ceux qui choisissent les cultures hors-sol (hydroponie/aéroponie), se retrouvent un jour confrontés à la gestion du pH de leur solution nutritive, avec toutes les questions qui se posent indubitablement : | |||
* pourquoi ça monte ? | |||
* pourquoi ça baisse? | |||
* pourquoi quand je mets moins de pH Down, ça baisse encore plus? | |||
* Pourquoi le pH me fait corriger chaque jour et fait le yoyo ?... | |||
<br> | <br> | ||
Bienvenue dans le monde merveilleux des réactions acido-basiques. | |||
<br> | <br> | ||
= Théorie générale = | |||
Un | == Acide, base et pH == | ||
Un acide, c'est un composé chimique qui à la capacité de donner au moins un proton hydrogène H{{Exp|+}} en solution aqueuse, on parle "ions acides". | |||
Une base, à l'inverse, est un composé qui peut recevoir au moins un proton H{{Exp|+}} en solution aqueuse. Ce sont les "ions basiques", principalement hydroxydes (OH{{Exp|-}}), mais d'autres réagissent comme des bases, comme les ions bicarbonates (HCO{{Ind|3}}{{Exp|-}}).<br> | |||
Il faut également parler des sels, ils sont simplement les produits d'un acide sur une base (acide+base = eau+sel). Généralement neutres, il existe cependant des sels acides comme le citrate de sodium, ou des sels basiques comme le bicarbonate de sodium.<br> | |||
L'acidité, qui se mesure en unités pH, reflète le rapport entre ions acides H{{Exp|+}} et les ions basiques hydroxydes OH{{Exp|-}}.<br> | |||
<br> | L'échelle pH va de 0 à 14, O étant l'extrême acide, 14 l'extrême base.<br> | ||
Un pH de 7 représente un juste milieu et est dit "neutre" car il compte autant de ions H{{Exp|+}} que de ions OH{{Exp|-}}.<br> | |||
A pH 0, le composé chimique acide contient une concentration molaire de 10e.0[H{{Exp|+}}] et 10e.-14[OH{{Exp|-}}].<br> | |||
A pH 14, le composé chimique basique contient une concentration molaire de 10e.-14[H{{Exp|+}}] et 10e.0[OH{{Exp|-}}]<br> | |||
Et entre les deux, le pH va représenter la différence entre les concentration de H{{Exp|+}} et OH{{Exp|-}}, par exemple :<br> | |||
pH 7 = 10e.-7[H{{Exp|+}}] 10e.-7[OH{{Exp|-}}]<br> | |||
pH 4 = 10e.-4[H{{Exp|+}}] 10e.-10[OH{{Exp|-}}]<br> | |||
Le total des 2 exposants est toujours égal à 14, et le pH correspond toujours à la concentration d'ions H{{Exp|+}} : pH signifie "potentiel hydrogène". Un simple regard sur la définition suffira à comprendre que la valeur pH est exponentielle : pH 6 est 10 fois plus acide que pH 7, ph 5 est 100 fois plus acide que pH 7, pH 4 est 1000 fois plus acide que ph 7, etc.<br> | |||
L'eau du robinet, en France, a un PH compris entre 7 et 8. Il nous faudra donc chercher a le faire baisser. Pour cela la manière la plus courante est d'utiliser du ph down, produit contenant des acides et permettant de faire baisser le ph d'une solution en en utilisant de très faibles doses. Pour faire remonter le ph d'une solution il faudra utiliser du ph up! Ces produits sont facilement trouvable dans les Growshops.<br> | |||
<br> | <br> | ||
== Réaction acido-basique == | |||
On a vu ci-dessus qu'un acide peut donner un H{{Exp|+}}, et une base le recevoir parce qu'elle est OH{{Exp|-}}. L'eau pure, H{{Ind|2}}O, peut donner un H{{Exp|+}}, vu qu'elle en à 2. Mais si elle le fait, elle devient : H{{Ind|2}}O - H = OH. Et si vous avez suivi, vous aurez compris qu'elle va également pouvoir récupérer un H{{Exp|+}}. Elle peut donc réagir en acide ou en base suivant son partenaire.<br> | |||
<br> | <br> | ||
Ce partenaire, on le trouve en quantité variable dans l'eau du robinet, mais surtout dans les engrais et additifs que vous allez utiliser, qui vont apporter tout un panel de molécules différentes. Certaines seront basiques, d'autre acides, certaines réagiront lentement, d'autres rapidement, vont se combiner entre elles pour en former de nouvelles qui vont encore agir différemment sur le pH de votre solution.<br> | |||
Lorsque vous corrigez votre solution avec du Ph down, vous incorporez des ions H{{Exp|+}}, qui vont se combiner aux OH{{Exp|-}} disponibles pour les "annuler", et faire baisser le pH de la solution car ils seront majoritaires. <br> | |||
Et ces H{{Exp|+}} majoritaires qui ne sont pas utilisés et vont rester "en attente" jusqu'à ce que d'autres OH{{Exp|-}} soient disponibles pour s'y combiner. Ces OH{{Exp|-}} (et aussi des H{{Exp|+}}) vont être produits par les réactions chimiques entre le substrat, la plante, et les composants des engrais et additifs que vous donnez à vos plantes.<br> | |||
Le plus imprévisible est la part d'azote de vos engrais, il est utilisé sous trois formes : les nitrates (ou azote nitrique, NO{{Ind|3}}-), l’azote ammoniacal (ou ammonium, NH{{Ind|4}}{{Exp|+}}) et l’urée CO(NH{{Ind|2}}){{Ind|2}}.<br> | |||
<br> | <br> | ||
[[Image:PH-art.jpg]]<br> | |||
<br> | <br> | ||
* Pour être assimilée, l’urée est d’abord transformée en azote ammoniacal par une réaction chimique qui provoque une acidification du milieu.<br> | |||
* Les nitrates n’auront pas d’incidence sur le milieu tant qu’ils ne seront pas consommés. Leur assimilation, par les plantes ou les bactéries vivant dans le substrat et la solution, ne fera augmenter le pH que légèrement par échange d’ions OH{{Exp|-}} ou HCO{{Ind|3}}{{Exp|-}}.<br> | |||
* L’absorption de NH{{Ind|4}}{{Exp|+}} se fait en contrepartie de la libération d’ions H{{Exp|+}}, donc une acidification. Mais intervient aussi une importante réaction chimique appelée nitrification par les bactéries du substrat, qui transforment l’azote ammoniacal en nitrate. La nitrification dégage des ions H{{Exp|+}} qui vont acidifier le substrat et faire descendre le pH.<br> | |||
<br> | <br> | ||
Ce dégagement qui perturbe l'équilibre désiré est amplifié ou amoindri par différents facteurs, tels que la température, la surface de solution au contact de l'air, de l'agitation de la solution, de la pression, de la nature des composés chimiques, des rejets de la plante,... et il est donc quasi impossible d'avoir une stabilité parfaite. Ce déséquilibre successif du pH est donc naturel et nécessaire, puisqu'il génère les nutriment essentiels dont la plante à besoin, mais sont compensés par l'adjonction de tampons : les tampons possèdent la propriété de résister au changement de la concentration en ions H{{Exp|+}}, et donc empêche le pH de varier outre-mesure.<br> | |||
<br> | <br> | ||
= Le pH et la plante = | |||
Les plantes possèdent un pH qui leur est propre. Le pH de la plante doit être le plus proche possible de celui de la solution nutritive et du substrat pour éviter tous risques de conflits électriques entre ses racines et les ions contenus dans la solution nutritive. En fonction de l'acidité de la solution et du substrat, les éléments contenus vont voir leur charge électrique varier, et si cette charge passe "hors-tolérance" de celle admise par les racines de la plante, l'élément de sera pas assimilable.<br> | |||
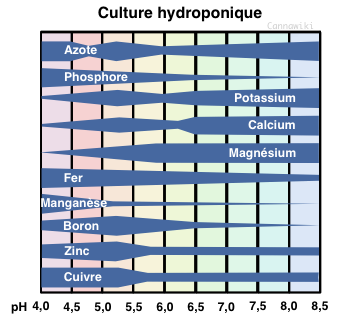
Notre plante chérie, pour pouvoir croître selon ses désirs, à besoin d'un pH compris entre 6 et 7,5 en terre et entre 5.3 et 6.5 en hydroponie, déterminé en fonction de l'engrais. En règle générale, il varie plutôt entre 5.5 et 6. Varie, ça ne veut pas dire qu'il doit bouger au cours de la culture : une fois atteint une valeur dans cette plage, on s'y tient! Et c'est là que commence tout l'art de la maîtrise du pH.<br> | |||
[[Image:PH 01.png|CannaWiki]][[Image:PH 02.png|CannaWiki]] | |||
== Substrat et pH == | |||
La terre ayant un pH d'origine variable en fonction de sa composition, et dans la plupart des cas est adapté à la culture du cannabis. Mais quelle que soit cette composition, il finira toujours par s'acidifier à cause de l'apport régulier d'engrais et donc de la formation de sels. Evitez de démarrer avec une terre trop acide, certains mélanges à base de tourbe ont un pH de 5 qu'il n'est pas rare de voir descendre à 4 au bout de 3 mois, avec tous les désagréments que cela peut apporter à une culture. Pour connaître le pH de la terre il suffit de diluer un échantillon de terre dans de l'eau distillée (eau pure) que nous testerons après quelques heures. Il existe également des appareils qu'il suffit de planter dans la terre quelques instants. Pour changer le pH de la terre nous pourrons utiliser de la chaux pour le faire remonter ou de la terre de bruyère pour le faire baisser.<br> | |||
En hydroponie, et je parlerai principalement des systèmes à billes d'argiles, il est primordial d'amener votre substrat à un pH adéquat, comprenez entre 5.5 et 6.0, et de faire en sorte qu'il y reste.<br> | |||
<br> | <br> | ||
Le | |||
<br> | === Le tamponnage === | ||
Les billes d'argiles, sont comme leur nom l'indique, faites d'argile. L'argile utilisée dans ce cas est de l'illite, composé de mica, de formule KAl{{Ind|2}}(AlSi{{Ind|3}}O{{Ind|10}})(OH){{Ind|2}}. A présent, vous avez du reconnaître le OH dans la formule et sa signification : les billes d'argile sont alcalines (basiques), leur pH tourne autour de 8 - 8.5, ce qui est bien trop haut pour espérer amener une culture à terme, il va falloir baisser leur pH entre 5.5 et 6, c'est ce qu'on appelle le tamponnage.<br> | |||
Pour tamponner des billes, rien de plus simple : il faut les laisser tremper dans de l'eau au pH voulu, jusqu'à ce que l'échange d'ions arrive au point d'équilibre recherché, que les billes contiennent plus d'ions H{{Exp|+}} que OH{{Exp|-}} et soient acides.<br> | |||
En regardant à nouveau la formule, on y voit un autre élément, la silice (Si). Lors de la cuisson des billes d'argile, il se peut que cette silice se vitrifie sous l'effet de la température, formant une enveloppe autour de la bille. Cette enveloppe, bien que fragmentée, peut considérablement ralentir le processus de tamponnage : les plus rapides seront tamponnées en 3 jours, d'autres marques peuvent prendre plus de 3 semaines. Il est normal que le pH de l'eau de trempage augmente, les ions H{{Exp|+}} étant captés parles billes, mais ce phénomène corrigé quotidiennement se ralenti puis se stabilise. Si vos billes sont trop vitrifiées, il faudra forcer la réaction en acidifiant plus encore votre eau de trempage : plus bas il sera, plus courte sera la durée. Il n'y a aucun inconvénient à démarrer avec un trempage à pH 2 ou 2.5, mais attention à ce que les billes ne soient pas trop acides au final! Il faudrait alors recommencer l'opération en sens inverse, avec une eau de trempage alcaline, et le risque d'avoir des billes chargées en sels toxiques (rappel : acide+base = eau+sel).<br> | |||
Votre tamponnage sera prêt lorsque l'eau de trempage des billes aura un pH entre 5.5 et 6, et que celui-ci n'aura pas bougé pendant une journée au moins.<br> | |||
<br> | <br> | ||
=== Le rinçage === | |||
Les sels, vous l'aurez compris, sont inévitables, et s'accumulent tout au long de la culture dans votre substrat, quel qu'il soit. Une trop grande accumulation de sels est toxique pour la plante, c'est pourquoi il est nécessaire de rincer les substrats réutilisables entre deux cultures.<br> | |||
Il s'agit à nouveau d'effectuer un trempage dans une eau à pH corrigé, qui heureusement sera moins long que le tamponnage. Pour faciliter et accélérer la solubilisation des sels, il suffit de baisser légèrement le pH de votre eau, pH 5 est parfait, et d'utiliser une eau chaude. On peut également y ajouter des enzymes pour dégrader les éléments restant, ou dans le cas d'une attaque par une maladie ou champignon faire un rinçage à l'eau de Javel. L'eau de Javel est une base, mais la courte durée de trempage (10-15mn suffisent) fait qu'elle affecte peu le pH des billes. Un second rinçage à l'eau claire et pH adapté est fortement conseillé après un rinçage à la Javel, pour éviter la formation d'éventuels précipités en réaction avec les engrais.<br> | |||
== Solution nutritive et pH == | |||
Une fois le pH de votre substrat adapté à celui de la plante, il faut que celui de la solution nutritive le soit aussi. Les engrais ont la propriété de faire baisser le pH de votre solution, et ils contiennent, en proportions variables suivant l'application à laquelle ils sont destinés et leur qualité, des tampons qui aident à stabiliser le pH.<br> | |||
Une fois l'engrais ajouté à votre eau, le pH de celle ci aura baissé, mais suivant le pH originel de votre eau, il se peut qu'il faille le corriger, généralement le faire baisser. Chose simple, il suffit d'ajouter quelques gouttes de pH down à votre solution. Je déconseille fortement l'usage d'acide acétique (vinaigre), citrique (jus de citron), ou chlorhydrique : les 2 premiers ne produise l'effet recherché que temporairement et vont s'associer aux engrais en formant un précipité ou une molécule complexe et non assimilable, quant à l'acide chlorhydrique il va s'attaquer en priorité aux atomes Ca{{Ind|2}} (calcium) et ainsi supprimer les tampons tant recherchés.<br> | |||
Le pH de votre solution devra bien évidement être identique à celui de votre substrat! Si votre tamponnage est correctement réalisé, et que votre solution nutritive est au même pH, il y aura très peu de variation, seuls les rejets de la plantes et la nitrification vont tenter de corrompre cet équilibre mais seront contenus par les tampons des engrais. La majorité des problèmes de pH "yoyo" tient du fait d'un mauvais tamponnage, par exemple de billes avec un pH de 7 et une solution à pH 5.5. Dans ce cas, le mieux est de refaire tremper ses billes et faire un tamponnage digne de ce nom. Si le pH monte mais se stabilise en dessous de 6.5, gardez cette valeur et continuez votre culture avec celle-ci.<br> | |||
Un autre phénomène physico-chimique dont je ne rentrerais pas dans les détails peut également être votre allié si votre pH baisse alors que vos billes sont bien tamponnées : l'oxydoréduction. En ajoutant de l'oxygène dans la solution par le biais d'un bulleur, certains éléments de la solution vont perdre un électron, et vont pouvoir capter les H{{Exp|+}} qui passent à proximité : le pH va sensiblement s'élever.<br> | |||
On peut également avoir recours à des tampons extérieurs, en ajoutant des éléments à base de silice tels que le Mineral Magic, mais ils ne constituent qu'un palliatif. La qualité de votre eau, de vos engrais, et du tamponnage de votre substrat sont les seules clés de la sérénité dans le monde impitoyable des réactions acido-basiques....<br> | |||
== Comment tester le pH d'une solution == | |||
Il existe différents systèmes permettant de connaître le PH de l'eau :<br> | |||
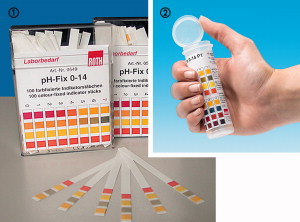
=== Le papier ph === | |||
Vous l'avez sûrement utilisé quand vous étiez en cours de biologie, c'est une petite languette de papier qu'il faut tremper dans la solution a tester. Cette languette de papier prend une certaine couleur en fonction du ph de l'eau, il suffira de comparer cette couleur avec la graduation fournie, chaque couleur équivaut a un degré de pH. Ce système est le moins cher mais également le moins précis.<br> | |||
[[Image:pH2.jpg]] [[Image:PH5.jpg|220px]] | |||
[[Image: | |||
[[Image: | |||
<br> | <br> | ||
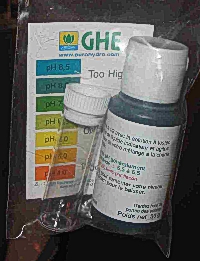
=== Les réactifs === | |||
Ce sont des produits surtout utilisé en aquariophilie, ou pour le test des piscines. Il suffit d'ajouter quelques gouttes de réactifs (liquide) dans une éprouvette ou nous aurons introduit la solution à tester. Cette solution prendra une teinte que nous devrons comparer avec une graduation de couleur. C'est a peu près le même principe que le papier pH. Il est également relativement peu cher et un tout petit peu plus précis! Ces tests sont facilement trouvable dans les animaleries.<br> | |||
[[Image:pH3.jpg]] | |||
<br> | <br> | ||
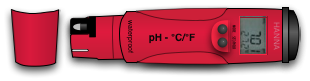
=== Les pH mètres === | |||
C'est le système le plus précis et le plus pratique! C'est un appareil à piles qu'il suffira de tremper dans la solution. Instantanément il nous donnera le degré de ph sous forme de chiffres inscrit sur un écran. Ce système est plus coûteux mais vraiment très pratique.<br> | |||
[[Image: | [[Image:Testeur_pH.png|pH HANNA]] | ||
<br> | <br> | ||
<br> | <br> | ||
'''''Auteur(s) et source(s) :''''' | |||
snowflake @ [http://www.cannaweed.com Cannaweed]<br> | |||
Riko @ [http://www.cannaweed.com Cannaweed] | |||
[ | |||
Dernière version du 12 août 2008 à 23:21
Introduction
Le pH a un impact bien défini sur la santé des plantes. Un niveau de pH incorrect peut rendre les nutriments indisponibles à la plante, et même causer leur disparition du sol. On trouvera ici comment contrôler cette variable volatile.
Le pH et les réactions acido-basiques
Tous les cultivateurs, et principalement ceux qui choisissent les cultures hors-sol (hydroponie/aéroponie), se retrouvent un jour confrontés à la gestion du pH de leur solution nutritive, avec toutes les questions qui se posent indubitablement :
- pourquoi ça monte ?
- pourquoi ça baisse?
- pourquoi quand je mets moins de pH Down, ça baisse encore plus?
- Pourquoi le pH me fait corriger chaque jour et fait le yoyo ?...
Bienvenue dans le monde merveilleux des réactions acido-basiques.
Théorie générale
Acide, base et pH
Un acide, c'est un composé chimique qui à la capacité de donner au moins un proton hydrogène H+ en solution aqueuse, on parle "ions acides".
Une base, à l'inverse, est un composé qui peut recevoir au moins un proton H+ en solution aqueuse. Ce sont les "ions basiques", principalement hydroxydes (OH-), mais d'autres réagissent comme des bases, comme les ions bicarbonates (HCO3-).
Il faut également parler des sels, ils sont simplement les produits d'un acide sur une base (acide+base = eau+sel). Généralement neutres, il existe cependant des sels acides comme le citrate de sodium, ou des sels basiques comme le bicarbonate de sodium.
L'acidité, qui se mesure en unités pH, reflète le rapport entre ions acides H+ et les ions basiques hydroxydes OH-.
L'échelle pH va de 0 à 14, O étant l'extrême acide, 14 l'extrême base.
Un pH de 7 représente un juste milieu et est dit "neutre" car il compte autant de ions H+ que de ions OH-.
A pH 0, le composé chimique acide contient une concentration molaire de 10e.0[H+] et 10e.-14[OH-].
A pH 14, le composé chimique basique contient une concentration molaire de 10e.-14[H+] et 10e.0[OH-]
Et entre les deux, le pH va représenter la différence entre les concentration de H+ et OH-, par exemple :
pH 7 = 10e.-7[H+] 10e.-7[OH-]
pH 4 = 10e.-4[H+] 10e.-10[OH-]
Le total des 2 exposants est toujours égal à 14, et le pH correspond toujours à la concentration d'ions H+ : pH signifie "potentiel hydrogène". Un simple regard sur la définition suffira à comprendre que la valeur pH est exponentielle : pH 6 est 10 fois plus acide que pH 7, ph 5 est 100 fois plus acide que pH 7, pH 4 est 1000 fois plus acide que ph 7, etc.
L'eau du robinet, en France, a un PH compris entre 7 et 8. Il nous faudra donc chercher a le faire baisser. Pour cela la manière la plus courante est d'utiliser du ph down, produit contenant des acides et permettant de faire baisser le ph d'une solution en en utilisant de très faibles doses. Pour faire remonter le ph d'une solution il faudra utiliser du ph up! Ces produits sont facilement trouvable dans les Growshops.
Réaction acido-basique
On a vu ci-dessus qu'un acide peut donner un H+, et une base le recevoir parce qu'elle est OH-. L'eau pure, H2O, peut donner un H+, vu qu'elle en à 2. Mais si elle le fait, elle devient : H2O - H = OH. Et si vous avez suivi, vous aurez compris qu'elle va également pouvoir récupérer un H+. Elle peut donc réagir en acide ou en base suivant son partenaire.
Ce partenaire, on le trouve en quantité variable dans l'eau du robinet, mais surtout dans les engrais et additifs que vous allez utiliser, qui vont apporter tout un panel de molécules différentes. Certaines seront basiques, d'autre acides, certaines réagiront lentement, d'autres rapidement, vont se combiner entre elles pour en former de nouvelles qui vont encore agir différemment sur le pH de votre solution.
Lorsque vous corrigez votre solution avec du Ph down, vous incorporez des ions H+, qui vont se combiner aux OH- disponibles pour les "annuler", et faire baisser le pH de la solution car ils seront majoritaires.
Et ces H+ majoritaires qui ne sont pas utilisés et vont rester "en attente" jusqu'à ce que d'autres OH- soient disponibles pour s'y combiner. Ces OH- (et aussi des H+) vont être produits par les réactions chimiques entre le substrat, la plante, et les composants des engrais et additifs que vous donnez à vos plantes.
Le plus imprévisible est la part d'azote de vos engrais, il est utilisé sous trois formes : les nitrates (ou azote nitrique, NO3-), l’azote ammoniacal (ou ammonium, NH4+) et l’urée CO(NH2)2.

- Pour être assimilée, l’urée est d’abord transformée en azote ammoniacal par une réaction chimique qui provoque une acidification du milieu.
- Les nitrates n’auront pas d’incidence sur le milieu tant qu’ils ne seront pas consommés. Leur assimilation, par les plantes ou les bactéries vivant dans le substrat et la solution, ne fera augmenter le pH que légèrement par échange d’ions OH- ou HCO3-.
- L’absorption de NH4+ se fait en contrepartie de la libération d’ions H+, donc une acidification. Mais intervient aussi une importante réaction chimique appelée nitrification par les bactéries du substrat, qui transforment l’azote ammoniacal en nitrate. La nitrification dégage des ions H+ qui vont acidifier le substrat et faire descendre le pH.
Ce dégagement qui perturbe l'équilibre désiré est amplifié ou amoindri par différents facteurs, tels que la température, la surface de solution au contact de l'air, de l'agitation de la solution, de la pression, de la nature des composés chimiques, des rejets de la plante,... et il est donc quasi impossible d'avoir une stabilité parfaite. Ce déséquilibre successif du pH est donc naturel et nécessaire, puisqu'il génère les nutriment essentiels dont la plante à besoin, mais sont compensés par l'adjonction de tampons : les tampons possèdent la propriété de résister au changement de la concentration en ions H+, et donc empêche le pH de varier outre-mesure.
Le pH et la plante
Les plantes possèdent un pH qui leur est propre. Le pH de la plante doit être le plus proche possible de celui de la solution nutritive et du substrat pour éviter tous risques de conflits électriques entre ses racines et les ions contenus dans la solution nutritive. En fonction de l'acidité de la solution et du substrat, les éléments contenus vont voir leur charge électrique varier, et si cette charge passe "hors-tolérance" de celle admise par les racines de la plante, l'élément de sera pas assimilable.
Notre plante chérie, pour pouvoir croître selon ses désirs, à besoin d'un pH compris entre 6 et 7,5 en terre et entre 5.3 et 6.5 en hydroponie, déterminé en fonction de l'engrais. En règle générale, il varie plutôt entre 5.5 et 6. Varie, ça ne veut pas dire qu'il doit bouger au cours de la culture : une fois atteint une valeur dans cette plage, on s'y tient! Et c'est là que commence tout l'art de la maîtrise du pH.
Substrat et pH
La terre ayant un pH d'origine variable en fonction de sa composition, et dans la plupart des cas est adapté à la culture du cannabis. Mais quelle que soit cette composition, il finira toujours par s'acidifier à cause de l'apport régulier d'engrais et donc de la formation de sels. Evitez de démarrer avec une terre trop acide, certains mélanges à base de tourbe ont un pH de 5 qu'il n'est pas rare de voir descendre à 4 au bout de 3 mois, avec tous les désagréments que cela peut apporter à une culture. Pour connaître le pH de la terre il suffit de diluer un échantillon de terre dans de l'eau distillée (eau pure) que nous testerons après quelques heures. Il existe également des appareils qu'il suffit de planter dans la terre quelques instants. Pour changer le pH de la terre nous pourrons utiliser de la chaux pour le faire remonter ou de la terre de bruyère pour le faire baisser.
En hydroponie, et je parlerai principalement des systèmes à billes d'argiles, il est primordial d'amener votre substrat à un pH adéquat, comprenez entre 5.5 et 6.0, et de faire en sorte qu'il y reste.
Le tamponnage
Les billes d'argiles, sont comme leur nom l'indique, faites d'argile. L'argile utilisée dans ce cas est de l'illite, composé de mica, de formule KAl2(AlSi3O10)(OH)2. A présent, vous avez du reconnaître le OH dans la formule et sa signification : les billes d'argile sont alcalines (basiques), leur pH tourne autour de 8 - 8.5, ce qui est bien trop haut pour espérer amener une culture à terme, il va falloir baisser leur pH entre 5.5 et 6, c'est ce qu'on appelle le tamponnage.
Pour tamponner des billes, rien de plus simple : il faut les laisser tremper dans de l'eau au pH voulu, jusqu'à ce que l'échange d'ions arrive au point d'équilibre recherché, que les billes contiennent plus d'ions H+ que OH- et soient acides.
En regardant à nouveau la formule, on y voit un autre élément, la silice (Si). Lors de la cuisson des billes d'argile, il se peut que cette silice se vitrifie sous l'effet de la température, formant une enveloppe autour de la bille. Cette enveloppe, bien que fragmentée, peut considérablement ralentir le processus de tamponnage : les plus rapides seront tamponnées en 3 jours, d'autres marques peuvent prendre plus de 3 semaines. Il est normal que le pH de l'eau de trempage augmente, les ions H+ étant captés parles billes, mais ce phénomène corrigé quotidiennement se ralenti puis se stabilise. Si vos billes sont trop vitrifiées, il faudra forcer la réaction en acidifiant plus encore votre eau de trempage : plus bas il sera, plus courte sera la durée. Il n'y a aucun inconvénient à démarrer avec un trempage à pH 2 ou 2.5, mais attention à ce que les billes ne soient pas trop acides au final! Il faudrait alors recommencer l'opération en sens inverse, avec une eau de trempage alcaline, et le risque d'avoir des billes chargées en sels toxiques (rappel : acide+base = eau+sel).
Votre tamponnage sera prêt lorsque l'eau de trempage des billes aura un pH entre 5.5 et 6, et que celui-ci n'aura pas bougé pendant une journée au moins.
Le rinçage
Les sels, vous l'aurez compris, sont inévitables, et s'accumulent tout au long de la culture dans votre substrat, quel qu'il soit. Une trop grande accumulation de sels est toxique pour la plante, c'est pourquoi il est nécessaire de rincer les substrats réutilisables entre deux cultures.
Il s'agit à nouveau d'effectuer un trempage dans une eau à pH corrigé, qui heureusement sera moins long que le tamponnage. Pour faciliter et accélérer la solubilisation des sels, il suffit de baisser légèrement le pH de votre eau, pH 5 est parfait, et d'utiliser une eau chaude. On peut également y ajouter des enzymes pour dégrader les éléments restant, ou dans le cas d'une attaque par une maladie ou champignon faire un rinçage à l'eau de Javel. L'eau de Javel est une base, mais la courte durée de trempage (10-15mn suffisent) fait qu'elle affecte peu le pH des billes. Un second rinçage à l'eau claire et pH adapté est fortement conseillé après un rinçage à la Javel, pour éviter la formation d'éventuels précipités en réaction avec les engrais.
Solution nutritive et pH
Une fois le pH de votre substrat adapté à celui de la plante, il faut que celui de la solution nutritive le soit aussi. Les engrais ont la propriété de faire baisser le pH de votre solution, et ils contiennent, en proportions variables suivant l'application à laquelle ils sont destinés et leur qualité, des tampons qui aident à stabiliser le pH.
Une fois l'engrais ajouté à votre eau, le pH de celle ci aura baissé, mais suivant le pH originel de votre eau, il se peut qu'il faille le corriger, généralement le faire baisser. Chose simple, il suffit d'ajouter quelques gouttes de pH down à votre solution. Je déconseille fortement l'usage d'acide acétique (vinaigre), citrique (jus de citron), ou chlorhydrique : les 2 premiers ne produise l'effet recherché que temporairement et vont s'associer aux engrais en formant un précipité ou une molécule complexe et non assimilable, quant à l'acide chlorhydrique il va s'attaquer en priorité aux atomes Ca2 (calcium) et ainsi supprimer les tampons tant recherchés.
Le pH de votre solution devra bien évidement être identique à celui de votre substrat! Si votre tamponnage est correctement réalisé, et que votre solution nutritive est au même pH, il y aura très peu de variation, seuls les rejets de la plantes et la nitrification vont tenter de corrompre cet équilibre mais seront contenus par les tampons des engrais. La majorité des problèmes de pH "yoyo" tient du fait d'un mauvais tamponnage, par exemple de billes avec un pH de 7 et une solution à pH 5.5. Dans ce cas, le mieux est de refaire tremper ses billes et faire un tamponnage digne de ce nom. Si le pH monte mais se stabilise en dessous de 6.5, gardez cette valeur et continuez votre culture avec celle-ci.
Un autre phénomène physico-chimique dont je ne rentrerais pas dans les détails peut également être votre allié si votre pH baisse alors que vos billes sont bien tamponnées : l'oxydoréduction. En ajoutant de l'oxygène dans la solution par le biais d'un bulleur, certains éléments de la solution vont perdre un électron, et vont pouvoir capter les H+ qui passent à proximité : le pH va sensiblement s'élever.
On peut également avoir recours à des tampons extérieurs, en ajoutant des éléments à base de silice tels que le Mineral Magic, mais ils ne constituent qu'un palliatif. La qualité de votre eau, de vos engrais, et du tamponnage de votre substrat sont les seules clés de la sérénité dans le monde impitoyable des réactions acido-basiques....
Comment tester le pH d'une solution
Il existe différents systèmes permettant de connaître le PH de l'eau :
Le papier ph
Vous l'avez sûrement utilisé quand vous étiez en cours de biologie, c'est une petite languette de papier qu'il faut tremper dans la solution a tester. Cette languette de papier prend une certaine couleur en fonction du ph de l'eau, il suffira de comparer cette couleur avec la graduation fournie, chaque couleur équivaut a un degré de pH. Ce système est le moins cher mais également le moins précis.

Les réactifs
Ce sont des produits surtout utilisé en aquariophilie, ou pour le test des piscines. Il suffit d'ajouter quelques gouttes de réactifs (liquide) dans une éprouvette ou nous aurons introduit la solution à tester. Cette solution prendra une teinte que nous devrons comparer avec une graduation de couleur. C'est a peu près le même principe que le papier pH. Il est également relativement peu cher et un tout petit peu plus précis! Ces tests sont facilement trouvable dans les animaleries.
Les pH mètres
C'est le système le plus précis et le plus pratique! C'est un appareil à piles qu'il suffira de tremper dans la solution. Instantanément il nous donnera le degré de ph sous forme de chiffres inscrit sur un écran. Ce système est plus coûteux mais vraiment très pratique.
Auteur(s) et source(s) :